Para combater a acidez estomacal e para desentupir um cano de cozinha, necessita-se, respectivamente, de uma base fraca e parcialmente solúvel e de uma base forte e solúvel. Assinale a opção que apresenta as respectivas fórmulas moleculares dessas bases.
Atente para o que se afirma a seguir sobre as propriedades periódicas dos elementos químicos:
I. Considerando o segundo período da tabela periódica, é correto afirmar que quanto maior a atração entre núcleo e eletrosfera, menor é o raio atômico.
II. Energia de ionização é igual à energia mínima necessária para “arrancar" um elétron de um átomo isolado em estado gasoso.
III. Em um mesmo período da tabela periódica, como os raios diminuem à medida que se aproximam dos gases nobres, a energia de ionização tende a diminuir nesse mesmo sentido.
IV. Conforme nos deslocamos para baixo da tabela periódica, o raio atômico cresce num mesmo grupo. Os elétrons de valência ficam menos atraídos e a energia de ionização cai.
É correto o que se afirma em
A molécula da anandamida é capaz de aliviar a ansiedade e induzir a uma situação de tranquilidade e relaxamento. O chocolate é uma das fontes dessa substância.
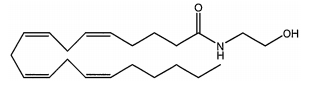
A fórmula molecular desse composto é a seguinte:
Do ponto de vista da química, o uso do sal de cozinha nos alimentos é importante porque
Um estudante administrou a eletrólise de sulfato de sódio aquoso usando eletrodos inertes e ao final identificou os produtos como hidrogênio
Em relação à teoria cinético-molecular dos gases, analise as afirmações abaixo e assinale a que for FALSA.
A descoberta do oxigênio por Joseph Priestley e Carl Wilhelm Scheele permitiu que Antoine Laurent Lavoisier combatesse uma teoria predominante do flogisto defendida por
Dois recipientes contendo, respectivamente, gás oxigênio e gás nitrogênio a uma temperatura de 25 °C estão interligados conforme a figura abaixo:
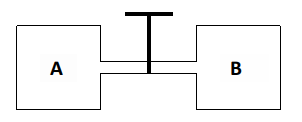
Sabe-se que o volume de oxigênio contido no recipiente A é de 1,5 L e sua pressão é 0,5 atm e o volume ocupado pelo nitrogênio no recipiente B é 0,5 L e sua pressão é 1,0 atm. Quando a válvula é aberta, a pressão total da mistura e a fração molar do gás oxigênio são em valores aproximados, respectivamente
p style="text-align: center;">
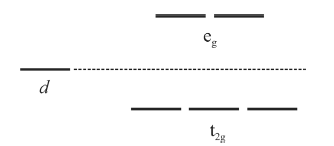
Na hemoglobina, um íon Fe 2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto.
A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe 2+ é d6, julgue o próximo item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este motivo, apresenta comportamento paramagnético.
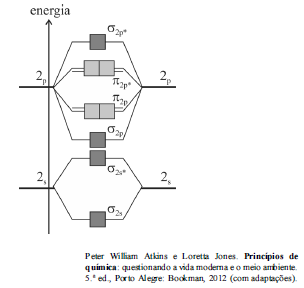
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
A TOM mostra que, no estado fundamental de energia, a molécula de O2 apresenta todos os elétrons emparelhados e, por esse motivo, não apresenta comportamento magnético.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fosforescência é um processo fotofísico lento, pois envolve uma transição radioativa entre estados de mesma multiplicidade.
Alguns reagentes específicos podem ser empregados na identificação de drogas ilícitas, por meio da formação de produtos coloridos e rapidamente identificáveis a olho nu, como o reagente de Marquis, empregado para identificar metanfetaminas; o reagente de Scott, usado para identificar cocaína; e o reagente de Simons, usado para discriminar entre anfetaminas e metanfetaminas. Tendo o texto precedente como referência inicial, julgue o item subsecutivo, relativo a aspectos diversos pertinentes a química analítica.
O volume de formaldeído 45% (densidade = 0,815 g × cm!3; massa molar = 30,031 g mol!1) necessário para se preparar 100 mL de uma solução de concentração 1,0 mol L!1 é superior a 82 mL.
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Se, na queima de um artefato pirotécnico ocorrer a decomposição do carbonato de bário, de acordo com a reação química BaCO 3(s) → BaO(s) + CO2(g), então a entalpia padrão dessa reação de decomposição (ΔHx), calculada a partir dos dados listados na tabela seguinte, será ΔHx = ΔH1 - ΔH2 + ΔH3.
O tetrafluoreto de xenônio é um sólido cristalino, formado como um dos produtos da reação direta entre os gases flúor e xenônio a cerca de 400 ºC. Ele é um composto muito reativo, podendo provocar explosões, incêndios e queimaduras.
A geometria molecular e o tipo de hibridação do átomo central no tetrafluoreto de xenônio são, respectivamente,
A tabela periódica do químico russo Dimitri Mendeleiev (1834-1907) foi a mais famosa tentativa de colocar os elementos químicos numa classificação ordenada. Nela, o autor ordenou os elementos em ordem crescente de massa atômica e colocava aqueles com propriedades semelhantes numa mesma coluna. A genialidade do químico russo estava em prever que novos elementos seriam descobertos e reservar espaços vazios para eles. As propriedades semelhantes resultam de configurações eletrônicas semelhantes da camada de valência dos elementos.
Acerca das configurações eletrônicas e das propriedades periódicas dos elementos, é INCORRETO afirmar que a