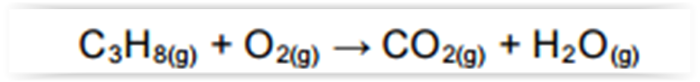Analise as seguintes afirmativas e a seguir assinale a alternativa correta:
I. A 300 K as pressões de equilíbrio de CO2, CO e O2 são, respectivamente, 0,6 atm, 0,4 atm e 0,2 atm. A constante de equilíbrio Kp para a reação representada por 2 CO2(g) 2 CO(g) + O2(g) é kp = 0,0889.
II. O valor de Kp a 2000 K para o equilíbrio: CO2(g) + H2(g) CO(g) + H2O(g) é 4,40. O valor de Kc nessas mesmas condições é kc = 4,40.
III. A constante de equilíbrio kc para a reação: 2SO2(g) + O2(g) 2SO3(g) é 249 a uma dada temperatura. Uma análise do conteúdo do recipiente que contém os três componentes nesta temperatura num determinado momento apresentou os seguintes resultados: [SO3] = 2,62 mol L-1, [SO2] = 0,149 mol L-1 e [O2] = 0,449 mol L-1. O sistema está em equilíbrio.
IV. A solubilidade molar do PbBr2 em água a partir do valor de kPS = 2,1x10-6 é 0,0081 mol L-1.
V. A 25°C a solubilidade molar do Ag3PO4 é 1,8x10-5 mol L-1. O kPS desse sal é kPS = 2,8x10-18
Assinale a alternativa correta:
Considerando a fórmula molecuar C 5H10O2 e as afirmações a seguir, assinale a alternativa correta:
I. A fórmula molecular C5H10O2 pode representar isômeros geométricos.
II. A fórmula molecular C5H10O2 não pode representar isômeros ópticos.
III. A fórmula molecular C5H10O2 pode representar isômeros de função.
IV. A fórmula molecular C5H10O2 pode representar isômeros de funções mistas.
V. A fórmula molecular C5H10O2 pode representar compostos cíclicos.
Assinale a alternativa correta:
Considere as seguintes afirmativas sobre os compostos de carbono e assinale a alternativa correta:
I. Os compostos orgânicos são muito mais numerosos do que os compostos que não contêm este elemento, pois o carbono pode, dentre outros fatores, formar ligações múltiplas, formar cadeias longas, curtas, lineares, ramificadas, cíclicas, saturadas e insaturadas, ligar-se a diferentes elementos.
II. A ligação insaturada de determinado hidrocarboneto é mais curta e mais forte que qualquer ligação simples de seu determinado análogo saturado, pois a hibridização sp3 de quaisquer dos carbonos do composto saturado não os permite sobrepor seus orbitais com os dos carbonos vizinhos.
III. A hibridização do carbono, dentre outros fatores, afeta a sua estrutura e, portanto, as suas propriedades, sendo as propriedades físicas mais amplamente afetadas que as propriedades químicas.
IV. A reatividade de um carbono terciário é sempre menor que a de um carbono primário, devido ao impedimento estéreo.
V. Compostos contendo ligações triplas, em geral, são mais reativos que seus compostos isólogos.
Assinale a alternativa correta:
Sobre a teoria atômica, considere as seguintes afirmações e assinale a alternativa correta:
I. Dalton chegou à conclusão da existência de átomos com base em observações químicas macroscópicas e não teve evidências diretas da existência de átomos.
II. Os experimentos de Thomson sobre o comportamento dos raios catódicos em campos magnéticos e elétricos proporcionaram a descoberta dos elétrons e permitiram que sua razão carga-massa fosse medida.
III. Os estudos de Rutherford mostraram que o átomo tinha um núcleo denso, carregado positivamente.
IV. De Broglie, Heisenberg, Born, Bohr e Planck foram cientistas que colaboraram para a teoria quântica moderna.
V. A dualidade onda-partícula, o princípio da incerteza, as funções de onda, a equação de Schrödinger, o princípio da exclusão de Pauli são contribuições recentes para a teoria atômica.
Assinale a alternativa correta:
Balanceie as equações químicas de I a V e na sequência assinale a alternativa correta:
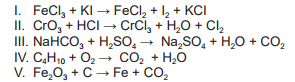
Assinale a alternativa que corresponde aos balanceamentos corretos das equações de I a V, considerando somente os mínimos números inteiros:
O gráfico p = f( V ) a seguir representa uma série de transformações para um mol de um gás de comportamento ideal.
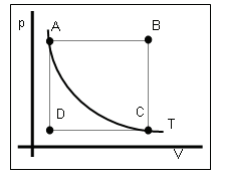
Identifique as transformações representadas por A→B, B→C, C→D, D→A e A→C e assinale a alternativa correta:
Ordene, de forma crescente, as forças de interação em:
I. Cristal de cloreto de sódio
II. Água pura
III. Acetona
IV. n-butano
V. Cloreto de sódio dissolvido em água
Agora assinale a alternativa que corresponde correta e respectivamente, à ordem crescente de força de interação das substâncias elencadas de I a V, anteriormente:
Com relação às interferências que podem ocorrer em espectrometria de absorção atômica em chama ( F AAS ) e em espectrometria de absorção atômica em forno de grafite ( GF AAS ), qual a alternativa com as afirmações corretas?
I) As interferências químicas podem ocorrer devido à formação, durante o processo de atomização, de espécies moleculares do analito termicamente instáveis.
II) As interferências espectrais podem ser causadas devido a sinais de absorção de fundo gerados por espécies moleculares não completamente dissociadas e/ou devido à presença de material particulado sólido, suspenso no sistema de atomização.
III) Sinais de absorção de fundo podem ser corrigidos empregando-se um sistema instrumental de correção, baseado no uso de uma lâmpada de deutério, tanto para análises realizadas na região do ultravioleta, como também na região do visível do espectro eletromagnético.
IV) As determinações analíticas realizadas pela técnica de GF AAS são mais susceptíveis à ocorrência de interferências espectrais do que aquelas realizadas pela técnica de F AAS.
V) As determinações analíticas realizadas pela técnica de F AAS são mais susceptíveis à ocorrência de interferências espectrais do que aquelas realizadas pela técnica de GF AAS.
Em relação às colunas empregadas na cromatografia em fase gasosa, qual afirmação está incorreta?
Utilizando a regra química de número de átomos de oxigênio menos o número de átomos de hidrogênio ionizáveis, assinale a alternativa que contém um ácido considerado forte:
Dois líquidos, X e Y, possuem massas específicas a 20°C de 500kg/m³ e 800kg/m³ , respectivamente. Em um tanque mantido à temperatura constante de 20°C, serão misturados 80m3 do líquido X com 40 toneladas do líquido Y, formando uma mistura líquida ideal Z. A massa específica da mistura Z, em kg/m³ , é aproximadamente:
Considerando-se a reação abaixo, assinalar a
alternativa CORRETA:
Assinalar a alternativa CORRETA:
Uma solução de ácido sulfúrico é preparada a partir de 9,8g de ácido sulfúrico, com pureza de 100%, acrescentando-se o ácido sobre a água destilada. Qual o volume de água, em litros, que deve ser adicionado à solução para que o pH final seja 2? (Dados: H = 1; S = 32; O = 16)
O hidróxido de magnésio (massa molar 58,33g/mol), conhecido como “leite de magnésia”, é frequentemente usado como antiácido para alívio de azia, má digestão e excesso de acidez no estômago. Considerando-se que uma colher (15mL) de leite de magnésia contenha 1.214mg de hidróxido de magnésio, qual a quantidade de matéria (mol) ingerida por um homem que administrou 5 doses (colheres) do medicamento ao longo do dia?