O petróleo é constituído por uma mistura de compostos químicos orgânicos (hidrocarbonetos), cujo estado físico, em condições normais de temperatura e pressão (CNTP), é predominantemente líquido, podendo assumir o estado gasoso quando a mistura contiver uma maior porcentagem de componentes com baixa massa molecular. O petróleo geralmente se apresenta associado à água, que, por sua vez, contém sais minerais em solução. Essa associação é devida, sobretudo, à tendência natural de acúmulo de água salgada gerada pelas formações geológicas nas partes inferiores de reservatórios de petróleo. Apesar de o tratamento que o óleo sofre nos campos de produção reduzir consideravelmente os teores de água, sais e sedimentos, os requisitos de altas vazões de óleo produzido impedem a remoção total da água salgada do petróleo. As águas de formação são compostas de vários tipos de sais; porém, costuma-se relacionar a salinidade global dessas águas em base de cloreto de sódio. Os sais contidos no petróleo constituem uma fonte de corrosão por gerarem ácido clorídrico (HCl) nas condições correntes nos equipamentos de destilação.
Internet: (com adaptações).
A partir das informações do texto precedente, julgue os próximos itens.
A água salgada residual presente no petróleo contendo sais minerais dissolvidos possui ponto de ebulição menor que o da água destilada à mesma pressão.
No que se refere a conceitos aplicados à química, julgue os itens a seguir.
Sistemas de filtração por pressão osmótica difundem os solutos em direção ao subsistema de maior concentração.
A água, quando está a 25 ºC, tem pressão de vapor igual a 3 172 Pa. Adicionando-se açúcar à água, a pressão de vapor irá
sofrer um , que se observa na
da temperatura de ebulição.
Preenchem as lacunas I e II, correta e respectivamente,
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
Com base nas informações e na figura apresentadas, é correto afirmar que os frascos identificados por A, B e C contêm, respectivamente, as soluções de
O soro fisiológico é uma solução isotônica em relação aos líquidos corporais que contém 0,9%, em massa, de NaCl em água destilada. Cada 100 mL da solução aquosa contém 0,9 gramas do sal. Um aumento na concentração de sal no soro fisiológico consumido por um paciente
Têm-se 3 substâncias alcoólicas e seus respectivos pontos de ebulição.
Metanol (64,5ºC)
Etanol (78,3ºC)
Propanol (97,2ºC)
Considere o gráfico de pressão máxima de vapor X temperatura:
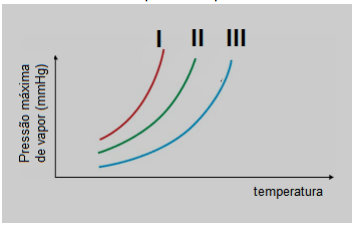
As substâncias I, II e III são, respectivamente:
Uma solução é preparada dissolvendo 4,8 kg de um composto de massa molar desconhecida em 120 g de água e tem o ponto de congelação de –1,50 °C. Considerando a constante crioscópica da água igual a 1,86 °C kg H2O/mol do soluto, a massa molecular do composto formado é
Do ponto de vista da química, o uso do sal de cozinha nos alimentos é importante porque
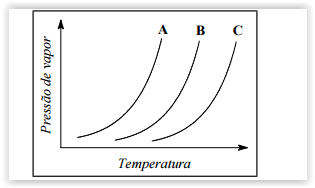
Em uma aula experimental de química, três soluções foram
submetidas à destilação. O gráfico a seguir representa o
comportamento dessas soluções.
Este gráfico evidencia o ponto de ebulição
O uso de aditivos anticongelamento de soluções é comum em países onde a temperatura recorrentemente atinge valores abaixo de O °C. Como poderia ser determinada a massa molar Mt do aditivo anticongelamento? Considere R a constante dos gases ideais, Te a temperatura de congelamento do solvente, Lc o calor latente de solidificação do solvente, m1 a massa molar do soluto, m2 a massa do solvente e .ᐃTc a variação da temperatura de congelamento do solvente e Kc a constante criométrica do solvente. Considere f como sendo o fator de conversão de unidades.
O átomo que possui a tendência de formar complexos com geometria quadrática plana, dentre os mencionados, é o
Assinale a alternativa correta.
Crioscopia é uma propriedade coligativa na qual o abaixamento da temperatura de congelamento de uma solução é diretamente proporcional à sua molalidade (relação
entre a quantidade de soluto em mol por 1 kg de solvente). Na adição de 1 g de 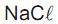 a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C.
a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C.
Qual a molalidade (w) aproximada da solução aquosa de 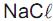 ?
?