Julgue os seguintes itens, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
![]()
Julgue os próximos itens, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Potencial de eletrodo é a medida do potencial individual de um eletrodo reversível no estado-padrão, ou seja, solutos em concentração de 1 mol/kg e gases à pressão de 1 bar, ambos a 273 K.
Julgue os próximos itens, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
Para determinar a capacidade de um metal em atuar como anodo de sacrifício, é adequado montar um eletrodo com o referido metal, com potencial desconhecido, ligá-lo a um eletrodo de potencial conhecido e medir a diferença de potencial entre os eletrodos. Nesse contexto, pode-se usar, para a avaliação, um eletrodo de zinco metálico (Zn), que, em uma célula eletroquímica com solução 1 mol/L de ZnSO4, apresenta a seguinte semirreação no anodo.
Zn (s) → Zn2+ (aq) + 2 e−
Julgue os seguintes itens, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue os seguintes itens, em relação à eletroquímica.
Considerando-se os potenciais de redução ![]() , é correto afirmar que um prego de ferro colocado em uma solução de HCl 1 mol/L permanece em seu estado inalterado.
, é correto afirmar que um prego de ferro colocado em uma solução de HCl 1 mol/L permanece em seu estado inalterado.
Julgue os próximos itens, a respeito da equação de Nernst e de potencial de eletrodo, eletrodos indicadores e medidas de pH.
A equação de Nernst tem por finalidade prever o potencial de uma pilha durante o seu funcionamento, correlacionando a variação do potencial da pilha em certo instante da reação com a variação das concentrações de produtos e reagentes.
Julgue os seguintes itens, em relação à eletroquímica.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
Supondo que todo o oxigênio produzido na eletrólise seja lançado na atmosfera, então, a 1 atm de pressão e 298 K de temperatura, uma tonelada de água submetida à eletrólise lançará mais de 500.000 L de oxigênio na atmosfera.
Julgue o seguinte item, relativo a fundamentos de eletromagnetismo.
Uma corrente elétrica que percorre um condutor gera, em torno desse condutor, um campo magnético com direção determinada pela regra da mão esquerda.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue os itens que se seguem.
Uma tonelada de água produzirá menos de 120 kg de hidrogênio em uma eletrólise.
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a)
Essa nanotecnologia aplicada na proteção contra a corrosão se baseia no(a)
Observe a pilha representada na imagem e baseado nos seus conhecimentos de eletroquímica julgue a veracidade das informações abaixo:
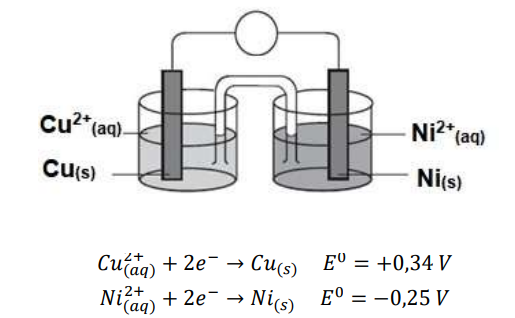
I. A região que sofre redução é o cátodo.
II. A placa de cobre que atua com ânodo e sofre corrosão.
III. O fluxo de elétrons do sistema vai da placa cobre para a placa de níquel
As afirmações verdadeiras são:
É possível ligar aparelhos elétricos de baixa corrente utilizando materiais comuns de laboratório no lugar das tradicionais pilhas. A ilustração apresenta uma montagem que faz funcionar um cronômetro digital.
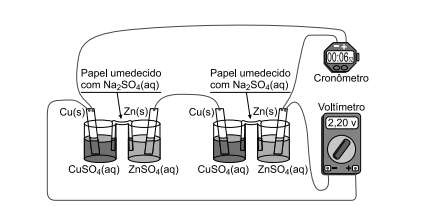
Utilizando a representação de projetos elétricos, o circuito equivalente a esse sistema é
O quadro lista alguns dispositivos eletrônicos que estão presentes no dia a dia, bem como a faixa de força eletromotriz necessária ao seu funcionamento.
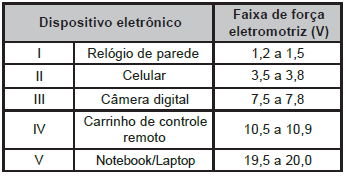
Considere que uma bateria é construída pela associação em série de três pilhas de lítio-iodo, nas condições-padrão, conforme as semiequações de redução apresentadas.

Essa bateria é adequada para o funcionamento de qual dispositivo eletrônico?



