O gás natural veicular (GNV) contido em um tanque de armazenamento ocupa um volume gasoso de 15 m3 e está submetido à pressão de 20 MPa às 6 h, quando a temperatura ambiente, em equilíbrio térmico com o gás, é de 10 °C.
Com relação a essa situação hipotética, julgue os itens seguintes, considerando que todos os gases se comportem idealmente,
que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se, às 18 h, a temperatura ambiente, em equilíbrio térmico com o gás, alcançar 30 °C, então, nessa nova situação, a pressão de gases no tanque será superior a 22 MPa.
O efeito Joule-Thompson é definido como a variação
A energia cinética de uma espécie em estado gasoso pode ser quantificada por um conjunto de variáveis, como tamanho das moléculas, temperatura e interação entre as moléculas. Assinale a alternativa que apresenta a equação que relaciona velocidade molecular (c) com temperatura (T).
5 g de gás hidrogênio (H2) foram misturados com 32 g de gás oxigênio (O2), em um recipiente de 10 L a 27 °C. Considerando o comportamento da mistura como o modelo de gás ideal, podemos informar que a pressão total do sistema em atmosfera vale:
Adotar nessa questão: R = 0,082 atm.L. mol-1 . K-1; T( K ) = 273 + T(°C); Massas atômicas: H = 1 e O = 16.
No que se refere a relações ponderais, balanceamento de reações químicas e leis dos gases ideais, assinale a opção correta.
O monóxido de nitrogênio, quando liberados pelos automóveis na baixa atmosfera, rapidamente se transforma em dióxido de nitrogênio, que em seguida, irá colaborar na formação do ozônio troposférico, um poluente. Um estudo dessa reação no laboratório revelou que, para que ela se tornasse quatro vezes mais rápida, poderia ser feita a seguinte alteração: manter fixa a concentração de O2 e duplicar a de NO.
Considerando o enunciado acima, atente para as seguintes afirmações:
I. A lei da velocidade dessa reação pode ser dada por: v = k[NO]2 [O2].
II. Essa deve ser uma reação elementar, ou seja, realizada em apenas uma etapa.
Sobre essas afirmações, é correto diz que
O estado gasoso é o mais simples e o mais estudado da matéria. Além disso, os gases têm muitas aplicações e muitas reações acontecem nessa fase. A respeito da lei dos gases ideais, é correto afirmar que
Muitos dos estudos sobre as reações químicas dizem respeito à rapidez com que elas ocorrem. As velocidades de reação variam desde aquelas que ocorrem em frações de segundos até aquelas que levam milhões de anos para acontecer. Com base nisso, considere os dados de cinética química para a reação abaixo:

A partir dessas informações, considere as seguintes afirmativas:
1- A reação é de primeira ordem em relação ao reagente A, e também de primeira ordem em relação ao reagente B.
2- A lei de velocidade da reação, baseada na estequiometria da reação, é velocidade = k [A][B]3, e a ordem global da reação é 4.
3- A lei de velocidade da reação, baseada nos dados experimentais, é velocidade = k [A][B], e a ordem global da reação é 2.
4- O valor de k para o experimento 2 é 36,79 L mol-1 s-1.
Assinale a alternativa correta.
Em relação à teoria cinético-molecular dos gases, analise as afirmações abaixo e assinale a que for FALSA.
Dois recipientes contendo, respectivamente, gás oxigênio e gás nitrogênio a uma temperatura de 25 °C estão interligados conforme a figura abaixo:
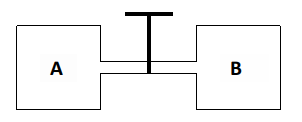
Sabe-se que o volume de oxigênio contido no recipiente A é de 1,5 L e sua pressão é 0,5 atm e o volume ocupado pelo nitrogênio no recipiente B é 0,5 L e sua pressão é 1,0 atm. Quando a válvula é aberta, a pressão total da mistura e a fração molar do gás oxigênio são em valores aproximados, respectivamente
O gráfico p = f( V ) a seguir representa uma série de transformações para um mol de um gás de comportamento ideal.
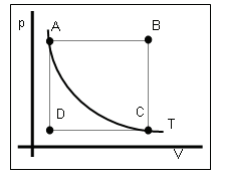
Identifique as transformações representadas por A→B, B→C, C→D, D→A e A→C e assinale a alternativa correta:
Sobre as propriedades dos gases ideais, julgue as sentenças a seguir:
I. O volume de um gás, à temperatura constante, diminui com o aumento da pressão.
II. O aumento da temperatura de um gás, à pressão constante, causa diminuição do volume do gás.
III. Um processo termodinâmico que ocorre a volume constante é chamado de processo isocórico.
Está(ão) correta(s) a(s) sentença(s):
Foi detectada a presença de 32µg de dióxido de enxofre em 100L
de ar de um recinto fechado que se encontra a 25°C (a 1 atm).
A composição em ppm (v/v) desse poluente no recinto,
considerando o comportamento ideal dos gases, é
aproximadamente igual a
Dados: Constante dos gases = 0,082 atm.L.mol–1.K–1. Massa molares
(g.mol–1): S = 32 e O = 16
Considerando a teoria dos gases julgue as
afirmativas a seguir:
I.Em um processo isotérmico, o volume de um gás
aumenta de modo diretamente proporcional ao
aumento da pressão.
II.As moléculas de um gás ideal se chocam de
modo perfeitamente elástico sem perda de
energia cinética média.
III.Um gás real aproxima-se do comportamento de
um gás ideal a pressões baixas e temperaturas
altas.
IV.As moléculas de um gás ideal se movimentam de
modo ordenado e a velocidades baixas.
V.Em um processo isobárico, o volume de um gás
aumenta de modo diretamente proporcional ao
aumento da temperatura.
Está correto apenas o que se afirma em:
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
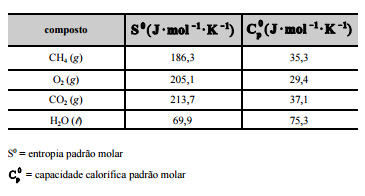
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Se o consumo mensal de energia elétrica da referida empresa
for de 1,0 × 1012 J, a combustão do CH4 (g), sob pressão
constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
CO2 para suprir as necessidades mensais de energia da
empresa.

