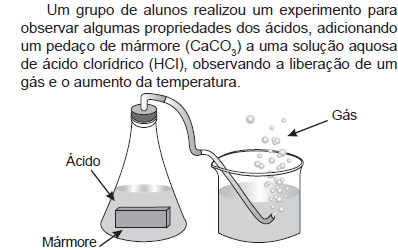
Com referência a metrologia, julgue os itens subsecutivos.
A metrologia científica utiliza instrumentos laboratoriais, pesquisas e metodologias científicas, com base em padrões
de medições nacionais e internacionais, para alcançar altos níveis de qualidade metrológica.
Com referência a metrologia, julgue os itens subsecutivos.
A metrologia industrial adota conceitos e ferramentas que se concentram em processos industriais, possibilitando a
calibração, verificação e validação de processos industriais de maneira precisa e confiável.
Com referência a metrologia, julgue os itens subsecutivos.
A metrologia utiliza conceitos de matemática aplicada, por exemplo, os algarismos significativos, utilizados para monitorar erros ao se representarem números reais na base 10.
Assinale a opção que apresenta correta a ordem decrescente de força dos oxiácidos HBrO, HBrO2, HBrO3 e HBrO4.
O ácido sulfúrico é um dos ácidos mais utilizados em indústrias e em laboratórios. O resíduo ácido gerado pelo seu uso pode provocar sérios danos ao meio ambiente. Em um laboratório, gerou-se uma grande quantidade de resíduo ácido a partir do ácido sulfúrico, o qual necessita ser neutralizado para o seu descarte. O técnico desse laboratório tem à sua disposição cinco substâncias: CaO, K2SO4, NaHSO4, CH3CH2OH e C6H9CONH2.
Qual dessas substâncias é a adequada para realizar esse tratamento?
A presença de substâncias ricas em enxofre em áreas de mineração provoca preocupantes impactos ambientais. Um exemplo dessas substâncias é a pirita (FeS2), que, em contato com o oxigênio atmosférico, reage formando uma solução aquosa ferruginosa, conhecida como drenagem ácida de minas, segundo a equação química:

Em situações críticas, nas quais a concentração do ácido sulfúrico atinge 9,8 g/L, o pH alcança valores menores que 1,0. Uma forma de reduzir o impacto da drenagem ácida de minas é tratá-la com calcário (CaCO3). Considere que uma amostra comercial de calcário, com pureza igual a 50% em massa, foi disponibilizada para o tratamento.
FIGUEIREDO, B. R. Minérios e ambientes. Campinas: Unicamp, 2000 (adaptado).
Qual é a massa de calcário, em gramas, necessária para neutralizar um litro de drenagem ácida de minas, em seu estado crítico, sabendo-se que as massas molares do CaCO3 e do H2SO4 são iguais a 100 g/mol e 98 g/mol, respectivamente?
Uma antiga forma de produzir um dos constituintes de argamassas é o aquecimento a altas temperaturas de materiais componentes dos sambaquis, que são sítios arqueológicos formados essencialmente por restos de moluscos. A decomposição térmica da principal substância
desses sítios arqueológicos resulta na formação de dois compostos apenas. Um deles é um óxido sólido e o outro é um óxido gasoso. A reação do primeiro com água resulta na formação de Ca(OH)2 (aquoso), enquanto a reação do segundo resulta em H2CO3 (aquoso).
A fórmula da principal substância encontrada nesses sítios arqueológicos é:
Um produto, obtido industrialmente da eletrólise de solução aquosa de cloreto de sódio, tem sido amplamente empregado na indústria, por exemplo, na fabricação de papéis, tecidos e sabões. Normalmente, esse produto é usado na desobstrução de encanamentos e sumidouros,
pois é capaz de reagir com gorduras. No entanto, a sua manipulação exige cuidados, pois é altamente corrosivo, podendo, em contato com a pele, provocar vermelhidão, irritação ou “queimaduras” de tecidos vivos. Além disso, se o frasco do produto for abandonado aberto por um longo
período de tempo, ele pode absorver CO2, convertendo-se em um sal.
Esse produto industrial é o
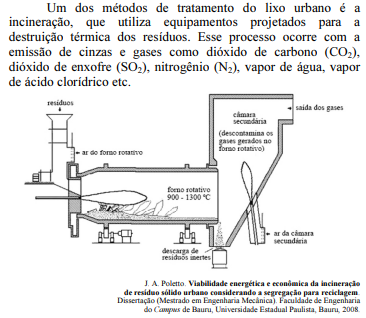
Considerando as informações e a ilustração apresentadas, julgue o próximo item.
Ao atingir a atmosfera, o SO2, em contato com a água, forma o ácido sulfuroso, que provoca a chuva ácida.
Caso 50 mL de uma solução de Mg(OH)2 0,1 mol/L sejam misturados com 50 mL de Mg(OH)2 0,25 mol/L, então, o volume de HCl 5 mol/L necessário para neutralizar completamente 30 mL dessa nova solução básica será
Um técnico analisou um lote de analgésicos que supostamente estava fora das especificações. A composição prevista era 100 mg de ácido acetilsalicílico por comprimido (princípio ativo, cuja estrutura está apresentada na figura), além do amido e da celulose (componentes inertes). O técnico realizou os seguintes testes:
1) obtenção da massa do comprimido;
2) medição da densidade do comprimido;
3) verificação do pH com papel indicador;
4) determinação da temperatura de fusão do comprimido;
5) titulação com solução aquosa de NaOH.
Após a realização dos testes, o lote do medicamento foi reprovado porque a quantidade de ácido acetilsalicílico por comprimido foi de apenas 40% da esperada.
O teste que permitiu reprovar o lote de analgésicos foi o de número
Os investigadores podem encontrar impressões digitais em objetos borrifando solução da substância X, que, ao entrar em contato com a substância Y, deixada no objeto pela pessoa que tocou nele anteriormente, reage, produzindo Z, uma substância branca que, quando exposta à luz solar, escurece, revelando as linhas das impressões digitais.
http://pibid-bio-uepg.blogspot.com/2013/08/as-funcoes-inorganicas-esua.html. Acesso em 09/06/2020. Adaptado.
A reação química descrita é:
AgNO3 + NaCl → AgCl + NaNO3
As substâncias X, Y e Z, descritas no texto, são denominadas, respectivamente,
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1.
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas