A labilidade dos complexos é uma propriedade importante que explica a troca de ligantes neste tipo de compostos. Sobre a labilidade de complexos, NÃO é correto afirmar:
O pentacloreto de fósforo é um sólido iônico composto de cátions PCl4+ e ânions PCl6- . Indique a alternativa que contém as formas geométricas do PCl4+ e PCl6- , respectivamente.
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
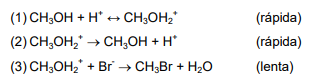
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo de metila, d[CH3Br]/dt, por meio da citada reação.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Todo par ácido fraco/base conjugada pode agir mais eficientemente como tampão em valores de pH próximos à neutralidade (pH = 7).
O Brasil é um dos maiores produtores de minério de ferro mundial, com reservas estimadas em 29 bilhões de toneladas. O processo de beneficiamento do minério até a obtenção do ferro gusa ou aço é chamado processo siderúrgico, sua obtenção ocorre através de algumas etapas. Analise as proposições indicadas a seguir atribuindo valores Verdadeiro V ou Falso F a elas:
( ) O minério de ferro para obtenção de aço a partir de processos siderúrgicos são obtidos em seus formatos oxidados, na forma de hematita (Fe2O3), Limonita (Fe2O3.H2O), Pirita (FeS2), entre outros.
( ) A redução do ferro é feita com a ajuda de elementos fundentes, como o calcário. Esse calcário reage com o minério para redução do número de oxidação do ferro. O calcário também fornece o carbono parte da composição final do ferro gusa.
( ) O ferro-gusa produzido possui um teor de carbono que varia entre 2 e 5%. Para obtenção de aço é necessário outra etapa, que é a descarbonização do ferro gusa em altos-fornos.
( ) O processo de laminação é feito a frio, para que não se diminua a resistência do aço produzido. A trefilação é feita a quente, para facilitar a formação dos fios.
Assinale a alternativa que apresenta, de cima para baixo, a sequência correta:
O gás mostarda é uma substância conhecida pela sua aplicabilidade como arma química. Acredita-se que essa substância foi utilizada durante a Primeira Guerra Mundial e que seus efeitos causavam queimaduras com formação de bolhas na pele e nas mucosas do trato respiratório, levando à cegueira e à morte por asfixia. A produção do gás mostarda ocorre mediante a reação química do dicloreto de enxofre (SCl2) com o eteno (C2H4), conforme a equação química a seguir.
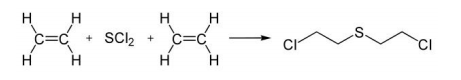
Sobre a equação de produção do gás mostarda, foram feitas a seguintes afirmações:
I. O eteno é um composto isomérico trans.
II. O gás mostarda tem fórmula molecular C4H8SCl2.
III. A reação orgânica de produção do gás mostarda é de substituição.
São incorretas as afirmações
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a
Após as manipulações cotidianas em um laboratório de química, o técnico lavou a vidraria utilizada e a colocou na estufa para secagem. O técnico errou se colocou na estufa
O descarte incorreto de resíduos químicos pode causar sérios danos aos indivíduos e ao meio ambiente.
Sendo assim, não se deve(m) descartar, na pia do laboratório,
Observe o esquema abaixo.
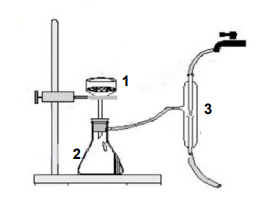
Nesse esquema os utensílios de laboratório indicados por 1, 2 e 3 são denominados, respectivamente,
Uma amostra de sulfato cúprico hidratado pesando 125,2 g foi seca em estufa a 110°C para remover toda a água de hidratação. Após a secagem, a amostra pesou 80,0 g. Então a fórmula do sal hidratado em questão é
Trifluoreto de boro reage com boridreto de sódio e produz tetrafluorborato de sódio e diborano, que, ao reagir com o oxigênio do ar, produz óxido de boro e água, como representado nas equações químicas não balanceadas:
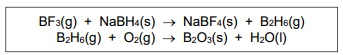
Partindo-se de 111 gramas de boridreto de sódio e considerando que este é o reagente limitante e, ainda, que o rendimento da reação é 90%, a massa, em gramas, de óxido de boro produzido será
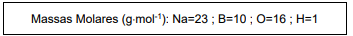
Com base nas seguintes informações, responda a questão.
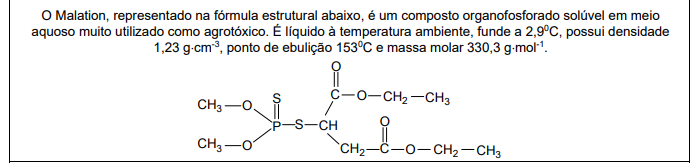
O teor (%) de fósforo em um mol desse composto é de aproximadamente,

São procedimentos importantes para uma etapa inicial que objetiva a clarificação da água, exceto:
“É um instrumento no qual contém componentes que geram energia luminosa e selecionam um comprimento de onda de luz específico. Em seguida, atravessa o raio de luz na amostra, mensurando a mudança da intensidade do feixe de luz após a travessia e, então, em um display, indica o valor da intensidade da luz.” Essa afirmação se refere ao:

