Em 1909, na Universidade de Manchester, no Reino Unido, sob a supervisão de Ernest Rutherford, Hans Geiger e Ernest Marsden executaram o experimento de Geiger–Marsden, também chamado de experimento da folha de ouro ou experimento de Rutherford. O experimento consistiu no bombardeamento de uma folha de ouro com 10-5 cm de espessura, envolvida por uma tela de sulfeto de zinco, com partículas alfa provenientes do elemento polônio, e a mensuração do espalhamento dessas partículas. Como resultado eles observaram que a maioria das partículas alfa atravessava a matéria (lâmina de ouro) sem desvios ou com desvios ínfimos; porém, uma em cada dez mil partículas alfa não atravessava a matéria, sendo defletida em um ângulo maior do que noventa graus.

A partir da análise do contexto acima, deduz-se que:
- Os resultados do experimento Geiger–Marsden inferem que a massa da matéria está localizada em pequenos pontos.
- Se o modelo Thomson estivesse correto as partículas teriam atravessado a folha de ouro sem qualquer deflexão das partículas.
- O experimento repetido com o uso de folhas de outros materiais com maior massa atômica que o ouro resulta em mais partículas defletidas.
É CORRETO o que se afirma em:
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A absorção de energia por uma molécula ocorrerá somente se as distâncias internucleares nos seus estados fundamental e excitado forem iguais.
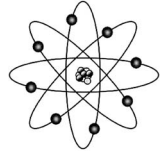
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem definidas para os elétrons de um átomo, conforme ilustrado na figura, mostrou-se, mais tarde, ser um equívoco, visto que os elétrons apresentam propriedades de ondas e, portanto, não podem ser descritos como partículas com trajetórias bem definidas.
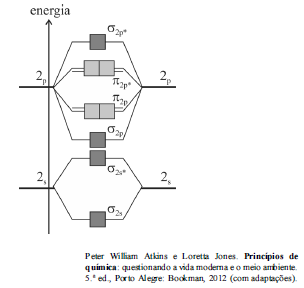
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2 + possui ordem de ligação maior do que a molécula neutra de O2.
Quanto ao postulado para o átomo de hidrogênio apresentado pelo modelo teórico para a estrutura eletrônica de átomos proposto por Bohr, que se baseia no modelo planetário introduzido por Rutherford, assinale a alternativa correta.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Na alquimia, a transformação da matéria era discutida a partir de concepções filosóficas permeadas de misticismo.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Apesar da grande contribuição da alquimia para a ciência, as primeiras transformações químicas conduzidas pelo ser humano aconteceram apenas com o surgimento da química moderna.
Considere a figura

O modelo atômico mais antigo capaz de explicar o fenômeno observado na figura é:
p style="text-align: center;">
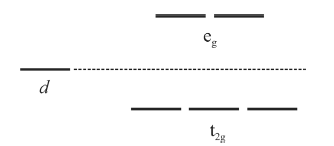
Na hemoglobina, um íon Fe 2+ se encontra coordenado a quatro átomos de nitrogênio de um anel porfirínico e a mais um nitrogênio de um grupo histidina que faz parte da proteína. A sexta posição na geometria octaédrica pode ser preenchida por uma molécula de O2 para formar a oxiemoglobina, responsável pelo transporte do O2 pela corrente sanguínea. De acordo com a teoria do campo cristalino, a oxiemoglobina consiste em um complexo de spin baixo. Por outro lado, se a molécula de O2 é substituída por uma molécula de H2O, tem-se então um complexo de spin alto.
A figura precedente mostra os níveis de energia para os orbitais d antes e após o desdobramento pelo campo cristalino em um complexo octaédrico.
Com base nas informações e na figura apresentadas e considerando que a configuração eletrônica do íon Fe 2+ é d6, julgue o próximo item, de acordo com a teoria do campo cristalino.
A oxiemoglobina possui 4 elétrons desemparelhados e, por este motivo, apresenta comportamento paramagnético.
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
A TOM mostra que, no estado fundamental de energia, a molécula de O2 apresenta todos os elétrons emparelhados e, por esse motivo, não apresenta comportamento magnético.
No que diz respeito à estrutura atômica da matéria e aos
modelos atômicos, julgue o item a seguir.
No modelo atômico de Bohr, denominado átomo nuclear, não existe nenhuma região de grande concentração de carga positiva ou negativa. As cargas estão uniformemente distribuídas pela esfera. Esse modelo desconsiderou que no átomo os valores de energia são quantizados e as transições eletrônicas envolvem liberação e absorção de energia.
A constituição da matéria está presente no vocabulário
científico desde a Grécia antiga, mas sem comprovação
científica, apenas filosófica. Como conhecimento
científico os modelos atômicos foram formulados a
partir de 1808 e à medida que novos e melhores métodos
de investigação foram sendo desenvolvidos, evoluídos.
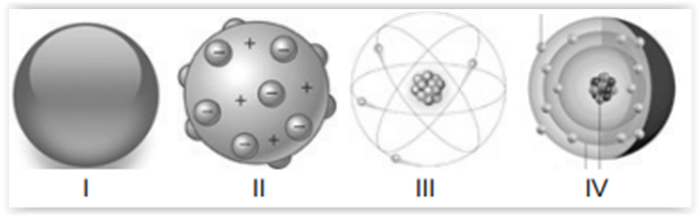
A seguir, são apresentadas as representações gráficas
de alguns modelos atômicos:
Julgue os itens a seguir:
( ) Dalton, figura I, tomou como base para o desenvolvimento
de seu modelo atômico análises de conservação e
proporcionalidade da massa em uma reação, originárias
de Lavoisier e Proust.
( ) O modelo atômico de Thomson , figura II, apresenta a
ideia de descontinuidade pela primeira vez e apresenta
a primeira subpartícula atômica encontrada: o elétron.
( ) A figura III representa o modelo atômico de Rutherford,
destacando o surgimento da ideia de núcleo positivo,
sem os nêutrons que só seriam descobertos por
Sommerfeld em 1932.
( ) A figura IV representa o átomo de Chadwick, organizando
os níveis de energia eletrônicos pela primeira vez.
Assinale a alternativa que contém a análise correta em
verdadeiro ( V) e falso (F ) para os itens apresentados.
Em 1911, Rutherford elaborou uma experiência, na qual ele bombardeou com partículas alfa (provenientes de uma amostra do elemento polônio, que é radioativo) uma fina placa de ouro e atrás dessa placa colocou um anteparo recoberto com sulfeto de zinco, que é uma substância fluorescente, onde era possível visualizar o caminho percorrido pelas partículas alfa. Ele notou que a maior parte dessas partículas atravessava a lâmina, e pouquíssimas eram repelidas ou desviadas. Então, com essa experiência, Rutherford provou que o átomo consiste em:
O cientista dinamarquês Niels Bohr aprimorou, em 1913, o modelo atômico de Rutherford, utilizando a teoria atômica de Max Planck. Esse modelo ficou conhecido como modelo atômico de Rutherford-bohr. Com relação a esse modelo assinale a alternativa correta.
Os elementos químicos são distribuídos na tabela periódica
levando em conta a ordem crescente dos números atômicos e a distribuição dos elétrons em subníveis e níveis,
que determinam o período e o grupo do elemento.
Considerando a distribuição dos elétrons, com destaque
para os subníveis que determinam a posição do elemento
na tabela periódica, está INCORRETA a associação entre
a distribuição dos elétrons em subníveis (1a coluna) e onúmero atômico (2a coluna) correspondente em