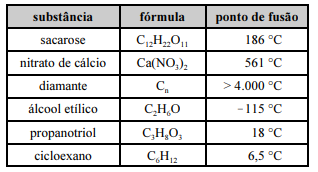
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Dado que viscosidade é a resistência que um líquido apresenta para fluir, o propanotriol é mais viscoso que o álcool etílico.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
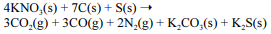
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato de potássio e o cátion do nitrato de alumínio é maior que 250,0 g/mol.

Considere as reações I, II e III a seguir.
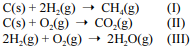
Com relação a essas informações, julgue o item que se segue.
A substituição de 1, 2 ou 3 átomos de hidrogênio por átomos de cloro na molécula de metano tornaria polares todos os compostos formados, contudo, caso os 4 átomos de hidrogênio na molécula de metano fossem substituídos por átomos de cloro, a molécula formada seria mantida apolar, como o próprio metano.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A energia de ligação entre os átomos de flúor em uma molécula de F2 é maior que a energia de ligação entre os átomos de nitrogênio em uma molécula de N2.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
O ponto de ebulição do etanal (CH3CHO) é maior que o ponto de ebulição do éter dimetílico (CH3OCH3).
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução aquosa de H 2S, a ordem decrescente de concentração das espécies presentes é [H2O] > [H3O+] > [H2S] > [S2-] > [HS-].
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH -] e pKb = -log Kb, julgue o seguinte item.
A solubilidade de um sulfeto metálico é tanto menor quanto maior for a acidez do meio.
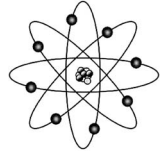
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem definidas para os elétrons de um átomo, conforme ilustrado na figura, mostrou-se, mais tarde, ser um equívoco, visto que os elétrons apresentam propriedades de ondas e, portanto, não podem ser descritos como partículas com trajetórias bem definidas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
Se a reação de desidratação de um alqueno ocorre de acordo com uma cinética de pseudoprimeira ordem, então o gráfico da concentração do alqueno em função do tempo terá aspecto conforme indicado no gráfico a seguir.
Em uma disciplina de química medicinal, os alunos foram instruídos a acompanhar o roteiro de aula prática descrito a seguir.

Qual(is) equipamento(s) de proteção individual (EPI) ou coletiva (EPC) não é(são) necessário(s) à realização dessa prática?
Ácidos e bases são rotineiramente usados nos experimentos de química. Caso não sejam manuseados e armazenados adequadamente, constituem um importante fator de risco no ambiente de laboratório. A respeito dos cuidados com o manuseio, armazenamento e descarte desses produtos químicos e seus resíduos, assinale a alternativa correta.
A medida precisa de massa é um fator imprescindível para as análises químicas atuais, e pode ser feita com o auxílio de balanças analíticas modernas. A respeito da instalação, operação e cuidados no uso da balança analítica, assinale a alternativa correta.
As análises gravimétricas podem ser consideradas métodos analíticos quantitativos clássicos, mas ainda na atualidade são empregadas para diversas finalidades. Nesse contexto, assinale a alternativa correta.
O CO2 é constantemente produzido no corpo por processos metabólicos intracelulares. No sangue, o CO2 dissolvido reage com a água, formando ácido carbônico. Rapidamente, o ácido carbônico dissocia-se em íons H+ e HCO3–. No organismo, o tampão bicarbonato constituído pelo par HCO3– e CO2 é o de maior importância fisiológica e envolve de maneira integrada os pulmões, o sangue e os rins. Considerando a ação tamponante desse sistema, que acontece segundo as reações descritas a seguir e a possibilidade de ocorrência de distúrbios do equilíbrio ácido-básico, analise as sentenças abaixo.
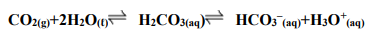
1) Caso ocorra maior produção de ácidos no organismo, decorrente de alguma situação patológica, por exemplo, o equilíbrio será deslocado para a esquerda, com maior produção de CO2 que será eliminado pelos pulmões.
2) Em indivíduos com dificuldades respiratórias e, portanto, maior quantidade de CO2 acumulado no organismo, pode acontecer deslocamento do equilíbrio, com elevação do pH fisiológico.
3) O consumo excessivo de bases, como os medicamentos antiácidos, por exemplo, pode ocasionar deslocamento do equilíbrio, e, em casos extremos, provocar o abaixamento do pH fisiológico.
Está(ão), correta(s), apenas:
A estimativa de que 70-75% da população mundial podem ser intolerantes à lactose (C12H22O11) levou a uma maior procura por produtos livres desse dissacarídeo naturalmente presente no leite e seus derivados. Esse cenário tem contribuído não apenas com o recente interesse das indústrias de alimentos no desenvolvimento de novos produtos com baixo teor de lactose, mas também impulsionou a recente regulamentação quanto à declaração obrigatória da presença de lactose nos alimentos com mais de 100 miligramas (mg) de lactose para cada 100 gramas ou mililitros do produto. Nesse contexto, assinale a alternativa que apresenta aproximadamente o número de mols de lactose presente em 100 mL de um produto com baixo teor de lactose, contendo 2500 mg de C12H22O11.
(Dados: massas atômicas C=12, H=1, O=16)


