O petróleo é constituído por uma mistura de compostos químicos orgânicos (hidrocarbonetos), cujo estado físico, em condições normais de temperatura e pressão (CNTP), é predominantemente líquido, podendo assumir o estado gasoso quando a mistura contiver uma maior porcentagem de componentes com baixa massa molecular. O petróleo geralmente se apresenta associado à água, que, por sua vez, contém sais minerais em solução. Essa associação é devida, sobretudo, à tendência natural de acúmulo de água salgada gerada pelas formações geológicas nas partes inferiores de reservatórios de petróleo. Apesar de o tratamento que o óleo sofre nos campos de produção reduzir consideravelmente os teores de água, sais e sedimentos, os requisitos de altas vazões de óleo produzido impedem a remoção total da água salgada do petróleo. As águas de formação são compostas de vários tipos de sais; porém, costuma-se relacionar a salinidade global dessas águas em base de cloreto de sódio. Os sais contidos no petróleo constituem uma fonte de corrosão por gerarem ácido clorídrico (HCl) nas condições correntes nos equipamentos de destilação.
Internet: (com adaptações).
A partir das informações do texto precedente, julgue os próximos itens.
Sais muito solúveis são aqueles que apresentam valores elevados da constante do produto de solubilidade (Kps) em uma dada temperatura.
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH -] e pKb = -log Kb, julgue o seguinte item.
Uma solução-tampão constituída por NH4C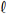
Quando um sal sólido se dissolve formando seus íons constituintes em solução, é possível medir o seu produto de solubilidade (Kps) no estado de equilíbrio. Observe a equação a seguir e as informações hipotéticas da tabela apresentada a respeito do produto de solubilidade do CaCO3 em água a 25°C e assinale a alternativa correta. Considere Kps de CaCO3 a 25ºC igual a 3,4×10-9.
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH -] e pKb = -log Kb, julgue o seguinte item.
A solubilidade de um sulfeto metálico é tanto menor quanto maior for a acidez do meio.
A solubilidade do cloreto de chumbo, em água a 25 °C, é 1,6x10-2 mol L-1. Portanto, a constante do produto de solubilidade é, aproximadamente, igual a
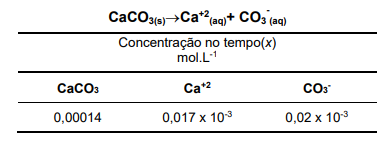
Substâncias no equilíbrio que estejam em fases diferentes dão origem aos equilíbrios heterogêneos. Um exemplo é representado pela equação a seguir:
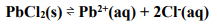
A expressão da constante de equilíbrio que representa a referida equação é:
A solubilidade molar do AgCl em água a temperatura ambiente é igual a 1,3x10-5 mol L-1. A adição de cloreto de sódio promove um aumento na concentração de íons Cl- na solução. Em decorrência dessa alteração, a solubilidade do AgCl será
Uma amostra de água subterrânea, submetida a análise, revelou
a presença de íons Ca2+, Mg2+ e Ni2+, entre outros, nas seguintes
concentrações, em mol.L–1: [Ca2+] = 1,0 x 10–4; [Mg2+] = 1,6 x 10–3
e [Ni2+]=1,7 x 10–4 Com a adição progressiva de íons CO32–,ocorreram precipitações de sais.
Utilizando a tabela da constante do produto de solubilidade
desses sais,
a ordem em que cada íon precipita é
A indústria química utiliza a fluorita (CaF2)para a obtenção do flúor elementar, de diversos produtos químicos designados genericamente de fluoroquímicos e do ácido fluorídrico (HF). O fluoreto de cálcio apresenta baixa solubilidade em água e sua constante do produto de solubilidade a 25C, é 3,9 x 10–11. A solubilidade do fluoreto de cálcio em uma solução 0,10 mol.L–1 de fluoreto de sódio nessa temperatura é, em mol.L–1:
A uma solução aquosa contendo íon cloreto adiciona-se
quantidade estequiométrica de íon prata, em pH ajustado
para precipitação de cloreto de prata.
Sendo o produto de solubilidade desse sal, na temperatura
do experimento, igual a 1,69 x 10-10 (mol L-1)2, a quantidade
máxima, em mg, de AgCl solúvel em 100 mL de solução saturada é, aproximadamente,
Dado: M(AgCl) = 143,3 g mol-1

