Considerando que esteja em equilíbrio a reação a A (g) + b B (g) ⇌ c C (g), em que a, b e c representam os coeficientes estequiométricos das substâncias A, B e C, respectivamente, assinale a opção correta.
É possível que algum candidato tenha na bolsa uma barra de chocolate, ou até mesmo balas, como fonte de nutriente. Nosso organismo, heterotrófico, precisa da glicose (C6H12O6) proveniente da alimentação para sobreviver e o hormônio da insulina deve estar presente, para permitir a entrada do carboidrato nas células. Uma empresa de táxi situada no centro da cidade convocou o corpo de bombeiros e o SAMU (Serviço de Atendimento Móvel de Urgência) para o resgate de um jovem de 315 kg que, devido a um mal súbito com desmaio, ficou preso entre os bancos de um dos automóveis da frota e não conseguia levantar-se sozinho. Após a análise médica e estabilização do paciente, foi constatado um quadro de hipoglicemia.
Se o nível de glicose do paciente for de 43 mg/dL (considere 1dL = 0,1 L), a conversão desta unidade de concentração em mmol/L de glicose resultará no valor aproximado de:
(Dados de massas molares: C = 12,0 g/mol; O = 16,0 g/mol; e, H = 1,0 g/mol.)
Em uma noite de segunda-feira, o Corpo de Bombeiros foi acionado para atender uma explosão ocorrida em um laboratório de ensino de química. Durante uma aula prática experimental, em que o professor demonstrava a síntese da água, a quantidade de gás hidrogênio (combustível) produzida foi elevada a ponto de ocasionar uma explosão no interior da capela, que se encontrava ocupada por bico de Bunsen em funcionamento. Com o acidente, ocorreu o derramamento de ácido e projeção de estilhaços de vidro. O professor e cinco alunos ficaram feridos e o local precisou ser interditado. No quadro de ensino constava a reação de síntese (não balanceada) a seguir:
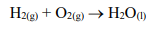
É CORRETO afirmar que, para 342g de gás oxigênio, a massa de gás hidrogênio necessária para a reação completa será aproximadamente de:
Sabe-se que a reação de combustão completa do acetileno (C2H2(g)) gera CO2(g) e H2O(v). Um aparato para liquefazer o vapor d’água gerado foi montado recuperando 75% da água produzida nessa reação, que foi equivalente à 135 ml de água a temperatura ambiente com densidade de 1,0 g/cm³.
Assinale a alternativa que apresenta a massa do CO2 gerada na reação:
![]()
Julgue os itens a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
Uma solução 0,5 mol/L de ácido clorídrico (HCl) será plenamente neutralizada caso reaja com o mesmo volume de uma solução 0,3 mol/L de hidróxido de bário, sem que haja excessos.
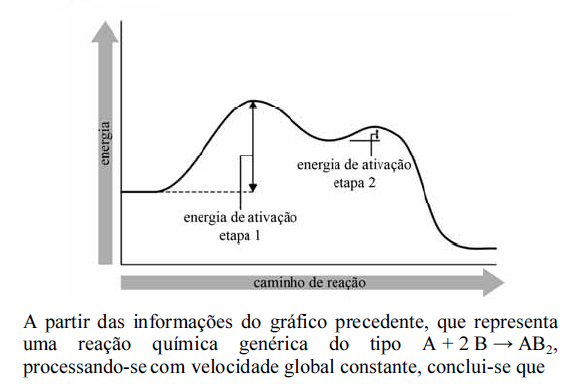
Considere o diagrama de energia para a reação X + Y → Z.
Os intervalos I, II e III representam, correta e respectivamente,
Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação
de entalpia menor que zero (ΔH < 0). Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
O gráfico que esboça a variação da energia potencial no progresso da reação é representado por:
Reações químicas ou transformações de fases que envolvem geração de produtos gasosos são extremamente perigosas uma vez que a fase gasosa ocupa um volume muito maior que a fase condensada. Logo, se a reação é abrupta fortes explosões relacionadas a expansão gasosa podem ocorrer. Considere um copo d’água de 360 ml sendo vaporizada e aquecida a 127°C.
Sabendo que um mol de gás ocupa 24,6 L à 27°C o volume ocupado pelo vapor gerado nessa transformação de fase é igual a:
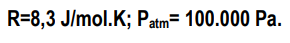
Julgue os itens a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
Ao se diluir 50 mL de uma solução 0,1 mol/L de Ba(OH)2em um balão volumétrico de 1 L, obtém-se uma solução 0,05 mol/L.
A velocidade de uma reação química é a taxa de variação da concentração de reagentes e produtos em um determinado momento.
Vários fatores afetam as velocidades das reações, assinale a alternativa incorreta sobre os fatores que afetam a velocidade de uma reação:
Julgue os itens a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
Sabendo-se que um mol de bário pesa 56 g, um de oxigênio pesa 16 g e um de hidrogênio pesa 1 g, um litro de uma solução 0,2 mol/L de Ba(OH)2 contém 18 g dessa base.
O metanoato de sódio (HCOONa) é um composto utilizado na indústria para a obtenção do ácido fórmico (HCOOH) por meio de uma reação com ácido sulfúrico (H2SO4). A reação está apresentada abaixo.
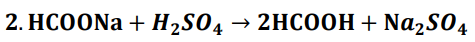
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=16 g/mol; H=1 g/mol.