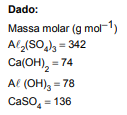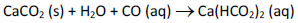Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Considere que a reação entre antimônio e sulfeto produza o sal Sb
2S3, pouco solúvel e de cor ocre que, em meio aquoso, dissocia-se parcialmente, de acordo com o equilíbrio Sb2S3(s) X 2Sb3+(aq) + 3S2-(aq). Nesse caso, a concentração de sulfeto necessária para iniciar a formação do sólido Sb2S3 em uma solução aquosa de Sb3+ de concentração x mol/L deverá ser maior que 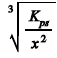
Em muitas situações de tratamento de águas, ocorre a necessidade de se alterar o valor do pH do meio, de forma a atender a determinadas exigências. O composto mais adequado para elevar o pH de um reator anaeróbio desequilibrado é
Considere os seguintes potenciais de redução, a 25,0 °C:
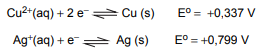
Quando um fio de cobre (Cu) é imerso numa solução aquosa de nitrato de prata (AgNO3), ocorre uma reação de óxido redução devido a
Considere os seguintes compostos:
I. Na2S2O3 − utilizado na remoção de cloro de águas de abastecimento.
II. MgSO4 − um dos compostos responsáveis pela dureza das águas.
III. HC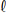
No que diz respeito ao tipo de ligação química que estas substâncias apresentam é correto afirmar que
Os elementos que possuem propriedades semelhantes são:
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, A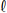
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido de cálcio. Admitindo que não haja variação de volume é correto afirmar que
O eletrodo de vidro é o mais utilizado na determinação do pH. Quando a membrana de vidro está imersa em uma solução, o seu funcionamento baseia-se na variação
A concentração de ácido fluorsilícico, H2SiF6, em mg/L, necessária para se obter o teor de 1,2 mg/L de íons fluoreto na água é igual a
Dados:
Massas molares (g/mol)
H = 1
Si = 28
F = 19
Acerca dos Conselhos Federal e Regionais de Química e do exercício da profissão de químico, julgue o item a seguir de acordo com a Lei n.º 2.800/1956 e com o Decreto n.º 85.877/1981.
O exercício da profissão de químico, em qualquer de suas modalidades, compreende ensaios e pesquisas em geral, pesquisa e desenvolvimento de métodos e produtos e magistério, independentemente de legislação específica.
Com relação à Resolução Normativa n.º 29/1971 do Conselho Federal de Química, que dispõe sobre o exercício da fiscalização e a imposição de penalidades, julgue o item a seguir.
O relatório de vistoria, o termo de declaração e a denúncia por escrito são peças integrantes da representação.
Acerca das propriedades e reações características de hidretos, ácidos, hidróxidos, óxidos e sal, julgue o item a seguir.
Quando adicionado à água, o hidreto de cálcio reage formando gás hidrogênio como um dos produtos.
Julgue o item a seguir quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Cavernas de calcário são formadas pela ação de dissolução das rochas calcárias pela água subterrânea, que contém dióxido de carbono, conforme a equação química a seguir.
A respeito de soluções e concentração de soluções, julgue o item a seguir.
Em termos de porcentual em massa, um reagente aquoso comercializado como uma solução a 70% contém 70 g de reagente para cada 100 g de solvente.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
A termoquímica é o ramo da química sobre a relação entre calor e transformações químicas. A quantidade de calor liberado ou absorvido em um sistema reagente depende da natureza da reação, das quantidades dos reagentes e das condições impostas na mistura reagente.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item a seguir.
A velocidade de uma reação química depende, essencialmente, do número total de colisões por unidade de tempo entre as partículas (átomos,moléculas ou íons) das espécies que participam da reação, bem como da fração de tais colisões que, efetivamente, promove a reação química.