Julgue o próximo item, relativo à natureza elétrica da matéria.
O primeiro modelo atômico que, baseado em método científico, explicou a natureza elétrica da matéria foi proposto por John Dalton, no século XIX.
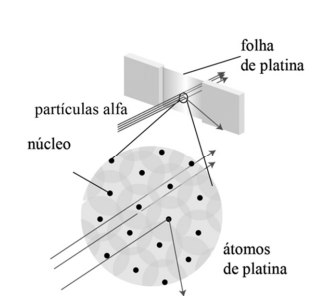
Certo cientista, em seus estudos acerca do modelo atômico, elaborou um experimento que consiste em lançar partículas alfa em uma folha de platina para explicar por que a maior parte dessas partículas atravessava quase sem desvios a folha de platina, enquanto algumas sofriam desvios grandes.
Internet: (com adaptações).
Em busca de respostas, esse cientista propôs o experimento e o modelo atômico da figura precedente e, ainda, inferiu que, quando uma dessas partículas com carga positiva atingia diretamente um dos núcleos de platina — muito pequeno, porém, muito pesado —, a partícula sofria um desvio muito grande, como se uma bola de tênis tivesse se chocado com uma bola de canhão parada.
Com base nessas informações, assinale a opção em que é apresentado o nome do cientista que propôs a referida explicação.
No que se refere a conceitos aplicados à química, julgue os itens a seguir.
O modelo atômico de Rutherford-Bohr considera a existência de orbitais circulares e elípticos, e o núcleo do átomo é composto por prótons e nêutrons.
Átomo é uma palavra que vem do grego e quer dizer “indivisível”. O homem na sua busca por tentar entender do que é feito a matéria buscou sempre formular modelos a respeito do átomo, que seria a menor parte da matéria. Porém, hoje sabe-se que mesmo o que chamamos de átomo na verdade possui partes distintas.
Sobre os modelos atômicas assinale a alternativa correta:
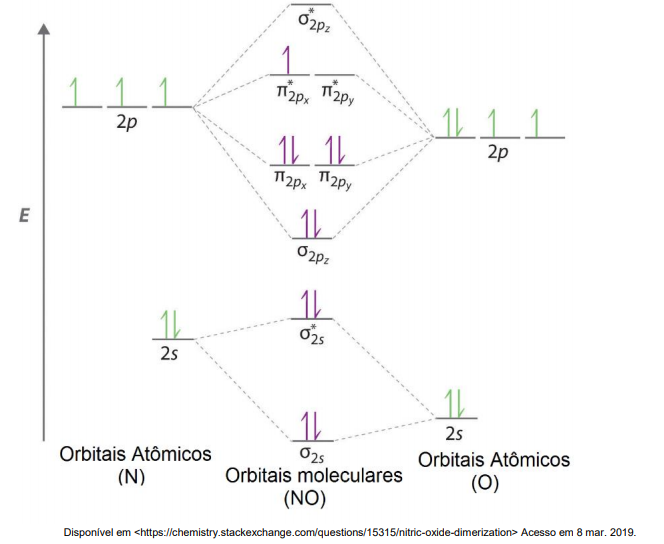
A Teoria dos Orbitais Moleculares (TOM) é uma ferramenta útil na descrição de ligações químicas, na avaliação da estabilidade química e na previsão de propriedades físicas das moléculas como absorção de luz e magnetismo. Utilizando o conceito de ordem de ligação (OL) [OL = (EOL - EOAL) / 2 ], em que EOL é o número de elétrons em orbitais ligantes e EOAL é o número de elétrons em orbitais antiligantes, é possível avaliar qualitativamente a estabilidade de uma determinada molécula. Abaixo segue o diagrama de orbitais moleculares para o óxido nítrico (NO), que no estado gasoso é uma molécula paramagnética.
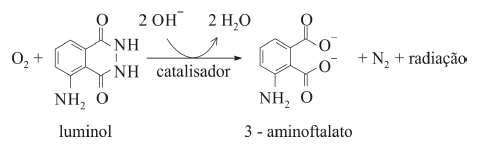
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
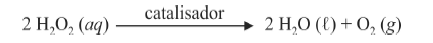
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Átomos de ferro e de manganês com números de massa iguais a 55 e 54, respectivamente, possuem o mesmo número de nêutrons.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fotoluminescência é um fenômeno que envolve unicamente transições entre níveis eletrônicos na matéria.
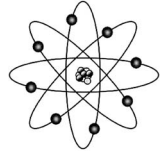
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem definidas para os elétrons de um átomo, conforme ilustrado na figura, mostrou-se, mais tarde, ser um equívoco, visto que os elétrons apresentam propriedades de ondas e, portanto, não podem ser descritos como partículas com trajetórias bem definidas.
Mesmo que um modelo atômico consiga explicar muitos fenômenos ele não explica tudo o que acontece, e pode ser substituído. Em se tratando de modelos atômicos analise as proposições abaixo:
I. O modelo de Dalton foi um resgate da primitiva teoria atômica de Epicuro que viveu entre 341 a.C. e 270 a.C.
II. Rutherford postulou que o átomo era uma esfera maciça de carga positiva com cargas negativas incrustadas na superfície.
III. O modelo de Bohr repousava na mecânica clássica e explicava perfeitamente a existência de órbitas estacionárias.
IV. O modelo atual foi concebido com as contribuições de De Broglie, Heisenberg e Schrödinger.
V. O número quântico spin foi introduzido por Wolfgang Pauli para explicar a descoberta da duplicação das raias espectrais.
Está correto o que se afirma somente em

A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A razão de os elementos químicos emitirem um espectro descontínuo de energia (espectros de linhas) é que, conforme proposto por Rutherford, os prótons ocupam uma região central muito pequena, denominada núcleo, ao passo que os elétrons se localizam em uma região extranuclear de dimensões muito maiores.
Considere a figura

O modelo atômico mais antigo capaz de explicar o fenômeno observado na figura é:
Sobre a teoria atômica, considere as seguintes afirmações e assinale a alternativa correta:
I. Dalton chegou à conclusão da existência de átomos com base em observações químicas macroscópicas e não teve evidências diretas da existência de átomos.
II. Os experimentos de Thomson sobre o comportamento dos raios catódicos em campos magnéticos e elétricos proporcionaram a descoberta dos elétrons e permitiram que sua razão carga-massa fosse medida.
III. Os estudos de Rutherford mostraram que o átomo tinha um núcleo denso, carregado positivamente.
IV. De Broglie, Heisenberg, Born, Bohr e Planck foram cientistas que colaboraram para a teoria quântica moderna.
V. A dualidade onda-partícula, o princípio da incerteza, as funções de onda, a equação de Schrödinger, o princípio da exclusão de Pauli são contribuições recentes para a teoria atômica.
Assinale a alternativa correta:
No início do século XX, Rutherford realizou um experimento com lâmina de ouro para comprovar a existência de partículas subatômicas. Uma das observações conclusivas dessa experiência foi que
Sobre a tabela periódica, considere as afirmações a seguir e assinale a alternativa correta:
I. A tabela periódica pode ser usada na previsão de muitas propriedades, muitas das quais cruciais para a compreensão dos materiais e das ligações químicas, e para a organização dos elementos de acordo com essas propriedades.
II. Incluem-se como algumas das propriedades periódicas o raio atômico, o raio iônico, a energia de ionização e a afinidade eletrônica.
III. Os blocos da tabela periódica são nomeados segundo o último orbital que é ocupado de acordo com o princípio da construção. Os períodos são numerados de acordo com o número quântico principal da camada de valência.
IV. A tabela periódica foi desenvolvida exclusivamente a partir das propriedades químicas dos elementos, de forma empírica.
V. Os elementos do bloco f têm propriedades químicas muito semelhantes, porque sua configuração eletrônica difere somente na população dos orbitais f internos e estes elétrons participam pouco da formação de ligação.
Assinale a alternativa correta:
No estudo dos modelos atômicos, a hipótese atômica de John
Dalton (1766-1844) é trazida para sala de aula dando base à
discussão sobre a constituição da matéria.
Para o desenvolvimento do trabalho sobre o modelo de Dalton é
importante a discussão sobre