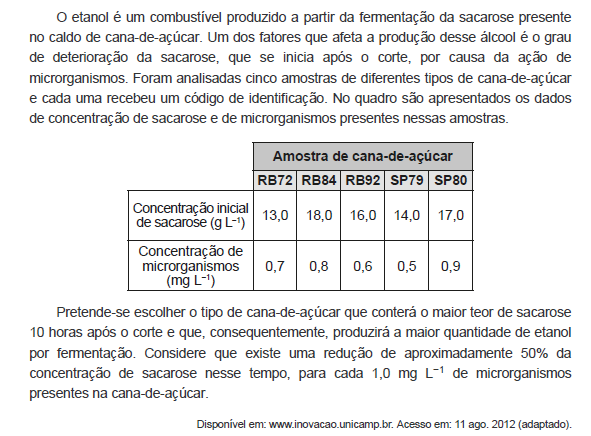
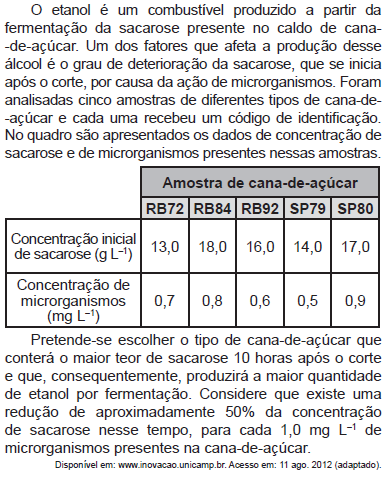
Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue os itens subsequentes.
Titulação potenciométrica é um método analítico utilizado para determinar a concentração de uma substância em uma solução com base na medição do potencial elétrico gerado durante uma reação química.
Sobre os métodos titulométrico e gravimétrico para análises de água, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O objetivo do emprego de técnicas complementares na gravimetria é obter compostos estáveis e puros, passíveis de terem suas massas quantificadas.
( ) Precipitação, eletrodeposição, volatilização ou extração são métodos que substituem a gravimetria para a determinação da quantidade de sólidos em amostras de água.
( ) A determinação de prata em amostras de água por volumetria se fundamenta na titulação da amostra com excesso de NaCl ou KCl e formação de precipitado de AgCl, que é filtrado, lavado, dessecado e pesado.
( ) Na titulometria, a substância química de referência empregada no preparo da solução-padrão deve ser quimicamente estável, ter alto grau de pureza e não reagir com o analito presente na amostra.
( ) O precipitado formado em análises gravimétricas deve ser minimamente solúvel, a fim de assegurar que não ocorram perdas durante as etapas de filtração e pesagem, com quantidade remanescente recuperada e mensurada acima da sensibilidade da balança.
A sequência está correta em
Para a análise, em laboratório, da presença de certa droga em uma amostra, adquiriu-se 1 mL de um padrão comercial contendo essa droga a uma concentração de 1 mg/mL. No preparo de uma solução estoque para o uso na calibração de um equipamento, um técnico utilizou uma pipeta para transferir
10 μL da solução padrão comercial para um balão volumétrico de 25 mL. Nessa situação hipotética, a concentração final da droga de interesse na solução estoque, em partes por milhão (ppm), seria igual a
O etanol a 70% (v/v) pode ser preparado a partir do etanol a 96% (v/v) pelo processo de diluição. Assim, o preparo de 1,0 L de etanol a 70% requer um volume de etanol a 96% de
Para o preparo de 250 mL de uma solução de NaCl 0,5 mol/L, sabendo-se que a massa molar do composto é igual a 58,44 g/mol, deve-se dissolver
Julgue os itens a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
As concentrações de soluções variam com a temperatura, já que estão sujeitas a dilatações e contrações à medida que a temperatura varia.
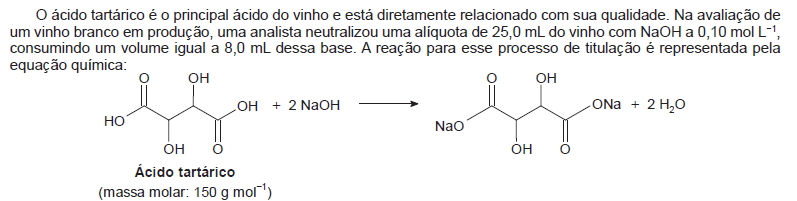
A concentração de ácido tartárico no vinho analisado é mais próxima de:
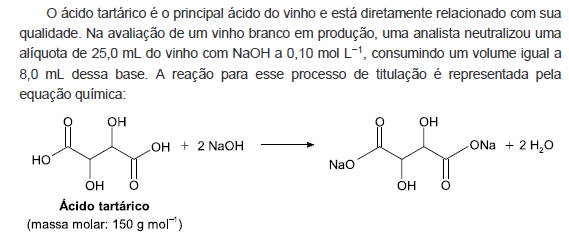
A concentração de ácido tartárico no vinho analisado é mais próxima de:
Leia o texto a seguir e resolva a questão:

Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto. Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1.
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas
Um técnico analisou um lote de analgésicos que supostamente estava fora das especificações. A composição prevista era 100 mg de ácido acetilsalicílico por comprimido (princípio ativo, cuja estrutura está apresentada na figura), além do amido e da celulose (componentes inertes). O técnico realizou os seguintes testes:
1) obtenção da massa do comprimido;
2) medição da densidade do comprimido;
3) verificação do pH com papel indicador;
4) determinação da temperatura de fusão do comprimido;
5) titulação com solução aquosa de NaOH.
Após a realização dos testes, o lote do medicamento foi reprovado porque a quantidade de ácido acetilsalicílico por comprimido foi de apenas 40% da esperada.
O teste que permitiu reprovar o lote de analgésicos foi o de número
Um técnico analisou um lote de analgésicos que supostamente estava fora das especificações. A composição prevista era 100 mg de ácido acetilsalicílico por comprimido (princípio ativo, cuja estrutura está apresentada na figura), além do amido e da celulose (componentes inertes). O técnico realizou os seguintes testes:
1) obtenção da massa do comprimido;
2) medição da densidade do comprimido;
3) verificação do pH com papel indicador;
4) determinação da temperatura de fusão do comprimido;
5) titulação com solução aquosa de NaOH.
Após a realização dos testes, o lote do medicamento foi reprovado porque a quantidade de ácido acetilsalicílico por comprimido foi de apenas 40% da esperada.
O teste que permitiu reprovar o lote de analgésicos foi o de número
A titulação ácido-base é conhecida como volumetria de
O ponto final de uma titulação de 5mL de uma solução de NaOH com HCl (0,2 mol.L-1 ) foi observado quando foram adicionados 20mL de HCl. Assinale a alternativa que indica corretamente a concentração obtida durante a titulação da solução de NaOH.