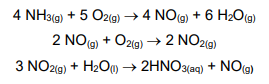Considerando-se uma reação de ordem zero e uma de primeira ordem, se ao se dobrar a quantidade de reagentes, respectivamente, a consequência é que
Sobre a constante de equilíbrio químico (K), é correto afirmar que
Considere as afirmativas dadas abaixo.
I. A primeira energia de ionização, I1, é a quantidade de energia necessária para remover o elétron mais fracamente ligado de um átomo gasoso.
II. A afinidade eletrônica é a alteração de energia quando um átomo gasoso ganha um elétron para formar um íon gasoso.
III. É modo geral, ao longo de um período, a carga nuclear efetiva Zef aumenta e, consequentemente, fica mais difícil remover um elétron.
Está(Estão) correta(s) a(s) afirmativa(s)
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
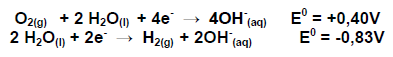
A ordem de grandeza da constante de equilíbrio K da pilha é
Na mesma família do sódio, segundo a tabela periódica, encontra-se o elemento químico césio. Uma amostra abandonada de seu isótopo 137 foi responsável pelo maior acidente radioativo registrado no Brasil, mais especificamente em Goiânia, no ano de 1987. Considerando, hipoteticamente, que a meia-vida deste isótopo fosse de 10 anos e que sua massa inicial em 1987 fosse igual a 30 g, em 2017 a massa, em gramas, que restaria seria de
Considerando as substâncias formadas pela ligação química de um átomo de carbono com i) 4 átomos de hidrogênio, ii) dois átomos de oxigênio e iii) um átomo de oxigênio e dois de hidrogênio, tem-se as afirmativas:
I- Uma das moléculas formadas apresenta geometria trigonal plana.
II- Uma delas possui ângulo de ligação igual a 104,5 °.
III- Todos são moléculas polares.
IV- Entre as forças intermoleculares presentes, não há, em nenhum caso, ligação de hidrogênio.
V- O composto formado por carbono e oxigênio deve apresentar o menor ponto de fusão entre os três.
Está correto o que se afirma em
As fórmulas estruturais de alguns carotenoides importantes são apresentadas a seguir:
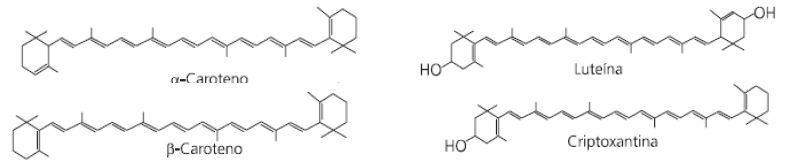
Sobre eles NÃO se pode afirmar que
Em um laboratório há 250 mL de uma solução de NaOH(aq.) pronta em um frasco, porém com a etiqueta rasgada e a concentração da solução está ilegível. Você decide fazer uma titulação para descobrir qual a concentração da solução e a massa de NaOH nela presente. Você põe em um erlenmeyer 20 mL de uma solução aquosa padronizada de ácido sulfúrico 0,15 mol/L e algumas gotas da solução alcoólica de fenolftaleína a 1%. Em seguida, com o auxílio de uma bureta, você transfere, gota a gota, para o erlenmeyer, a solução aquosa de NaOH. A solução do erlenmeyer apresenta uma coloração rósea permanente após serem transferidos 15 mL da solução alcalina. Dessa forma, pode-se dizer que a massa, em gramas, de NaOH presente nos 250 mL de solução é de: Considerando que as massas molares em g.mol-1 são Na = 23, H = 1,S = 32 e O = 16, pode-se dizer que a massa, em gramas, de NaOH presente nos 250 mL de solução é de
Considerando as espécies químicas H +, Cu+, Mg2+, BF3, Au+, NH4+, BH3, F-, NH3, I- e C6H6, responda às questão.
Sobre as espécies apresentadas não se pode afirmar que
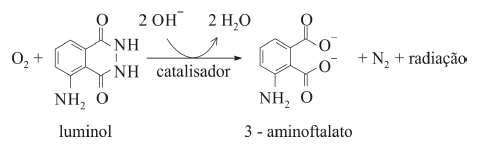
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
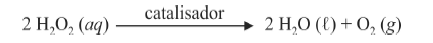
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A partir das posições relativas dos elementos na tabela periódica, é possível inferir que um átomo neutro de ferro apresenta maior raio atômico do que um átomo neutro de manganês.
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
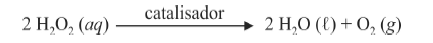
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a 176,0 g/mol.
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
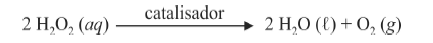
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização ácida do H2O2 é superior a 2,0%.
Tendo em vista que a inclusão de marcadores fotoluminescentes em munição livre de chumbo faz que o disparo de munição marcada dessa maneira produza resíduos luminescentes facilmente identificáveis na presença de luz ultravioleta, julgue o item subsequente, relacionado ao fenômeno de fotoluminescência envolvido nessa aplicação.
A fotoluminescência é um fenômeno que envolve unicamente transições entre níveis eletrônicos na matéria.
O ácido nítrico é muito utilizado pela indústria química, principalmente em processos de nitrificação de compostos orgânicos, na fabricação de vernizes, fertilizantes agrícolas, celuloses, salitre (nitrato de potássio), pólvora negra, trinitrotolueno (TNT), nitroglicerina, seda artificial, ácido benzoico, fibras sintéticas, galvanoplastia, ácido pícrico, nylon, entre outros. A produção industrial de ácido nítrico se dá pelo Processo Ostwald, que envolve as seguintes reações químicas:
Supondo-se que o rendimento esperado nesse processo seja de 90% e que a amônia utilizada apresente 20% de impurezas, a massa de amônia, em toneladas, necessária para obtenção de 6,3 t de ácido nítrico será de, aproximadamente:
Muitas moléculas possuem mais de um centro quiral e, portanto, uma série de isômeros possíveis. Considere as quatro representações químicas a seguir (I, II, III e IV) para a molécula do 2-bromo-3- cloro-butano.
Sobre essas representações é correto afirmar que