Considerando o excerto, analise afirmativas correlatas e a relação proposta entre elas.
I. “Quando a presença de cianotoxinas é identificada na água utilizada para consumo humano, é obrigatória a comunicação imediata às clínicas que realizam hemodiálise e aos laboratórios farmacêuticos que produzam medicamentos injetáveis.”
PORQUE
II. “Em função dos riscos à saúde associados às cianotoxinas, é permitido o uso de algicidas na estação de tratamento, tais como sulfato de cobre, permanganato de potássio ou qualquer outro agente químico que provoque lise das células, para fins de controle do crescimento das cianobactérias, o que pode deixar resíduos na água.”
Assinale a alternativa correta.
Considerando os padrões físico-químicos e microbiológicos relativos à água potável destinada ao abastecimento das populações humanas, analise as afirmativas a seguir.
I. O intervalo aceitável para o valor de pH no sistema de distribuição se situa entre 6,0 e 9,5.
II. A determinação da cor, turbidez e teor residual de desinfetante deve ser realizada em todas as amostras coletadas para análises microbiológicas.
III. A concentração mínima de cloro residual deve ser de 0,2 mg/mL em toda a extensão do sistema de distribuição; nos pontos de consumo deve ser de 2 mg/mL.
IV. A coleta de amostras para pesquisa de coliformes totais e Escherichia coli em mananciais superficiais deve ser realizada mensalmente e o volume mínimo de amostra a ser analisado deve ser de 1.000 mL.
V. Na água tratada para consumo humano, o parâmetro microbiológico para coliformes totais e Escherichia coli usado como indicador de contaminação fecal e de eficiência de tratamento é “ausência em 0,1 L de amostra”.
Está correto o que se afirma apenas em
Analise as afirmativas a seguir.
I. A pesquisa de coliformes deve ser feita em amostras de águas mantidas sob refrigeração, por um período que não exceda 24 horas.
II. Para pesquisa de sulfatos e sulfetos, a amostra deve ser mantida sob refrigeração após adição de HNO3 para manutenção de pH acima de 8.
III. O HNO3 é utilizado na determinação de alumínio, cobre, zinco, manganês e ferro em amostras de água, a fim de obter valor de pH inferior a 2.
IV. A medida de O2 dissolvido em amostras de água deve ser realizada em até 24 horas após coleta, em amostras mantidas em temperatura ambiente.
V. Para pesquisa de coliformes deve ser adicionado 0,1 mL de solução de Na2S2O3 a 1,8% para cada 100 mL de amostra, contendo cloro residual após a autoclavação dos frascos.
Está correto o que se afirma apenas em
O fenômeno conhecido como chuva ácida causa efeitos extremamente nocivos ao ambiente como, por exemplo, alteração da vida aquática, danos à vegetação e corrosão de construções. A água da chuva não poluída já é naturalmente ácida (pH = 5,5) devido a sua interação com o gás carbônico atmosférico. No entanto, diversos países no mundo têm registrado severas alterações, chegando a níveis de pH médio anual para água da chuva em torno de 3,5.
Em comparação com a água da chuva não poluída, pode-se afirmar que a acidez média anual registrada por esses países é cerca de
O potencial hidrogeniônico (pH) de uma solução determina a quantidade de íons de hidrogênio presentes nessa solução e serve como modo de mensurar o seu grau de acidez, neutralidade ou alcalinidade. Considere duas soluções, A e B, de dois ácidos com pH iguais a 3,8 e 5,8, respectivamente.
Sobre essas soluções é correto afirmar que:
Considere as soluções aquosas a seguir, todas de concentração 0,1 mol/L.
O menor pH e a menor condutibilidade elétrica são observados, respectivamente, nas soluções de:

Sobre titulação, assinale a alternativa correta:
O ácido oxálico (H2C2O4) está presente em caules e folhas de vegetais como o espinafre e a beterraba. Uma maneira de quantificar a concentração de ácido oxálico nos vegetais é através da titulação com hidróxido de sódio (NaOH). Para realizar uma titulação, pretende-se escolher um indicador adequado para o ponto de equivalência mostrado no gráfico. O quadro apresenta os indicadores disponíveis no laboratório.

O indicador adequado para essa titulação é o(a)
Prepara-se uma solução tampão para analisar os vários íons presentes em uma solução para que tenha concentrações de equilíbrio de ácido bórico de 7,0 . 10-5 mol/L e borato de sódio 4,0 . 10-5 mol/L. Estime o pH dessa solução a 25ºC.
Dados: Ka = 5,79 . 10-10 ; pKa = 9,24 ; Log(0,57) = - 0,24 ; Log(1,70) = 0,23 ; Log(1,75) = 0,24

Dessa forma, assinale a alternativa correta:
Em todo o mundo, há uma crescente busca por mudanças em diversos processos produtivos por motivos ligados a três preocupações: meio ambiente, energia e economia global. Assim, a busca por sustentabilidade se relaciona com a química da água, que inclui sua utilização em vários processos industriais. Esses processos tentam adequar os parâmetros de qualidade e o padrão de potabilidade da água. Nesse contexto, assinale a alternativa correta.
De um balão volumétrico de 1 L, contendo HCl (ácido forte) de concentração 10-3 mol/L, retira-se uma alíquota de 1 mL. O pH dessa alíquota é:
A respeito de equilíbrio químico e de eletroquímica, assinale a opção correta.
Soluções contendo ácido acético (CH3COOH) e acetato de sódio (CH3COONa) frequentemente são empregadas como solução tampão. Assinale a alternativa que apresenta o valor de pH de uma solução que contém 0,5mol.L-1 de ácido acético e 0,5mol.L-1 de acetato de sódio. Considere a constante de ionização do ácido = 4,76.
(Dados: log 1= 0)
Uma amostra de volume “a" mL de solução de um ácido monoprótico foi titulada com solução 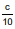 molar de uma monobase, usando-se como indicador a fenolftaleína. O ponto de viragem foi observado quando foram consumidos “b" mL da solução titulante. Então, a concentração normal da solução titulada (Nt) pode ser expressa por
molar de uma monobase, usando-se como indicador a fenolftaleína. O ponto de viragem foi observado quando foram consumidos “b" mL da solução titulante. Então, a concentração normal da solução titulada (Nt) pode ser expressa por


