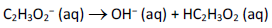Uma reação de precipitação a partir da mistura de duas soluções pode ser escrita representando-se todos os íons envolvidos ou somente os íons que realmente participam da reação, omitindo-se os íons espectadores. Assim, a reação de precipitação de cromato de prata a partir de uma solução de cromato de potássio e de uma solução de nitrato de prata pode ser escrita na forma completa e na forma resumida, respectivamente, como:
As quantidades máximas de oxigênio molecular gasoso e de água líquida que podem ser produzidas na reação de decomposição de 1 litro de uma solução aquosa 0,4 mol.L-1 de peróxido de hidrogênio é:
Uma solução tampão é usualmente constituído pela combinação de um ácido ou base fraco e um sal originado do mesmo ácido ou base. Entretanto, é possível constituir-se uma solução tampão a partir de um único componente. Um exemplo de um composto que, sozinho em solução, é capaz de agir como um tampão, é
Acerca dos Conselhos Federal e Regionais de Química e do exercício da profissão de químico, julgue o item a seguir de acordo com a Lei n.º 2.800/1956 e com o Decreto n.º 85.877/1981.
A responsabilidade administrativa de cada Conselho Regional cabe ao respectivo presidente, inclusive a prestação de contas perante o órgão federal competente.
Acerca dos Conselhos Federal e Regionais de Química e do exercício da profissão de químico, julgue o item a seguir de acordo com a Lei n.º 2.800/1956 e com o Decreto n.º 85.877/1981.
Compete aos profissionais de química, de forma privativa e exclusiva, o exercício de atividades de pesquisa e desenvolvimento de operações em estabelecimentos industriais que fabriquem produtos dietéticos e alimentares.
Com relação à Resolução Normativa n.º 29/1971 do Conselho Federal de Química, que dispõe sobre o exercício da fiscalização e a imposição de penalidades, julgue o item a seguir.
No caso de acolhimento de representação, diante de evidente infração de dispositivos legais, o presidente do Conselho Regional de Química determinará a lavratura da intimação.
Acerca das propriedades e reações características de hidretos, ácidos, hidróxidos, óxidos e sal, julgue o item a seguir.
Os hidretos são compostos inorgânicos binários que apresentam o hidrogênio como o elemento mais eletropositivo.
Acerca das propriedades e reações características de hidretos, ácidos, hidróxidos, óxidos e sal, julgue o item a seguir.
Quando o ácido acético ioniza‐se em solução aquosa, a reação é escrita conforme a seguir.
Julgue o item a seguir quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Quando o composto carbonato de cálcio é aquecido a uma temperatura alta, decompõe‐se na forma de óxido de cálcio (conhecido como cal viva ou cal virgem) e gás dióxido de carbono.
A respeito de soluções e concentração de soluções, julgue o item a seguir.
O porcentual em volume é comumente utilizado para especificar a concentração de um soluto preparado pela diluição de um composto líquido puro em outro líquido.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
A quantidade de calor que é absorvida ou liberada por um sistema durante uma variação independe de como a variação ocorre.
No que se refere à termoquímica, a reações exotérmicas e endotérmicas e à variação de entalpia, julgue o item a seguir.
Grande parte dos processos químicos é conduzida à pressão constante ou quase constante. Com isso, o calor absorvido em uma reação é igual à soma do aumento na energia do sistema com qualquer trabalho realizado sobre o sistema.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item a seguir.
A velocidade de uma reação é proporcional às concentrações dos reagentes, com exceção das reações de ordem zero, em que as variações de concentração não produzem nenhum efeito.
Julgue o item a seguir, relativo a ácidos e bases.
Indicadores ácido‐base são comumente utilizados nas titulações de ácidos e bases, sejam fracos ou fortes. O indicador é um ácido ou uma base cujas espécies protonadas (ou desprotonadas) têm cores diferentes. Em solução aquosa, o comportamento de um indicador depende essencialmente do valor de pH.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
Célula eletroquímica é um dispositivo ou sistema que converte energia elétrica em química ou vice‐versa, formado por dois eletrodos em contato com um eletrólito. Em uma pilha galvânica, um conjunto de células eletroquímicas é usado para a produção de eletricidade como resultado de uma reação química espontânea. Em uma célula eletrolítica, a corrente elétrica é usada para produzir uma transformação química.