Com base nas seguintes informações, responda a questão.
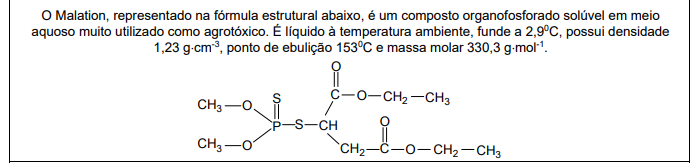
Na molécula desse composto há
A tabela periódica é uma das realizações mais notáveis da Química porque ajuda a organizar a extensa quantidade de propriedades dos elementos, que, de outra forma, seria um arranjo confuso. A tabela periódica pode ser usada na previsão de um grande número de propriedades, muitas das quais são cruciais para a compreensão das características químicas e físicas dos compostos.
Sobre as propriedades periódicas dos átomos, pode-se afirmar que
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2(s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
A maior parte da produção de amônia, nos dias atuais, é utilizada para a produção de fertilizantes. Esse processo é conhecido como Haber-Bosch. Parte de nitrogênio (N2) e Hidrogênio (H2) formando a amônia (NH3). A reação é executada entre 400 e 450° C e 600 atm (atmosferas) e pode ser representada pela equação abaixo.
____N2(g)+_____H2(g) ⇔ _____ NH3(g)
Assinale a alternativa que completa correta e respectivamente as lacunas nos balanceamentos da reação acima.
Sobre as ligações iônicas, assinale a alternativa que completa correta e respectivamente as lacunas do texto.
Os compostos iônicos são resultados da reação entre um metal e um ametal. Os elétrons são transferidos do ______________ para o _______________ formando os______________e os________________ respectivamente. Um exemplo de reação desse tipo ocorre quando colocamos gás cloro em contato com sódio metálico, formando assim o cloreto de sódio.
Sabendo-se que a massa molar do ouro (Au) é 197 g mol-1 (gramas por mol), calcule a massa em gramas (g) de 1 átomo desse elemento e assinale a alternativa correta. Utilize o número de Avogadro como sendo 6 x 1023.
Sobre Hidrólise, podemos afirmar, exceto:
Com relação à potenciometria, marque a alternativa incorreta.
Em colorimetria, para a aferição da cor, temos, exceto:
A imagem abaixo representa:

Tendo o texto acima apenas como referência inicial, julgue o item seguinte de acordo com o Código de Ética dos Profissionais da Química (Resolução Ordinária n.º 927/1970).
O profissional da química deve divulgar informações sobre trabalhos ou estudos do contratante do seu serviço, independentemente de autorização deste, em respeito ao princípio da publicidade.

Tendo o texto acima apenas como referência inicial, julgue o item seguinte de acordo com o Código de Ética dos Profissionais da Química (Resolução Ordinária n.º 927/1970).
O profissional da química tem a opção de recursar contato com jovem profissional ou colega que esteja em busca de encaminhamento para emprego ou orientação técnica.

Tendo o texto acima apenas como referência inicial, julgue o item seguinte de acordo com o Código de Ética dos Profissionais da Química (Resolução Ordinária n.º 927/1970).
A quebra de sigilo profissional não pode ser considerada como infração ao Código de Ética, já que a referida atitude não está listada no rol taxativo de infrações.

Tendo o texto acima apenas como referência inicial, julgue o item seguinte de acordo com o Código de Ética dos Profissionais da Química (Resolução Ordinária n.º 927/1970).
O julgamento pelo Conselho Regional terá caráter sigiloso e a decisão será tomada pelo voto da maioria simples dos membros do Plenário, em votação aberta.
Sobre os volumes ocupados por 1 mol de NaCl sólido (densidade = 2 g/mL), 1 mol de H2O líquida (densidade = 1 g/mL) e 1 mol de H2 gasoso, a 25 ºC e 1 atm, pode-se afirmar que


