A rotina no laboratório de química expõe alunos, técnicos e docentes a várias situações potenciais de risco de acidentes que podem ser evitadas. A esse respeito, qual(is) o(s) procedimento(s) mais adequado(s) a ser(em) adotado(s) nesse ambiente de trabalho?
Observe as ilustrações a respeito dos símbolos/pictogramas de perigo a serem adotadas nos rótulos dos produtos químicos, de acordo com o sistema de padronização e harmonização da classificação e rotulagem preventiva de produtos químicos globalmente aceito e correlacione-as com as informações a seguir.

( ) Usada para indicar: risco à saúde, de carcinogenicidade, mutagenicidade, toxicidade para a reprodução, sensibilização respiratória, toxicidade no órgão-alvo, perigo por aspiração.
( ) Usada para indicar: risco à saúde, de irritação (pele e olhos), sensibilização cutânea, irritação das vias aéreas superiores, efeito narcótico, toxicidade aguda (nocivo), perigo à camada de ozônio.
( ) Usada para indicar: líquidos oxidantes.
( ) Usada para indicar: gases sob pressão.
A sequência correta, de cima para baixo, é:
A medida precisa de volume é tão importante para um método analítico quanto a medida precisa da massa. Entretanto, medidas confiáveis de volume exigem uma série de cuidados no uso dos aparatos volumétricos. A respeito do uso adequado das pipetas volumétricas analise as sentenças, e em seguida, assinale a alternativa correta.
O cálcio apresenta elevada abundância em solos e águas naturais, e diversas metodologias analíticas podem ser empregadas para a sua adequada quantificação. Desde a década de 50 até os dias atuais, o método titrimétrico de complexação do cálcio com EDTA, em meio alcalino, tem sido empregado com êxito para essa finalidade. Acerca das titulações de complexação com o EDTA, assinale a alternativa correta.
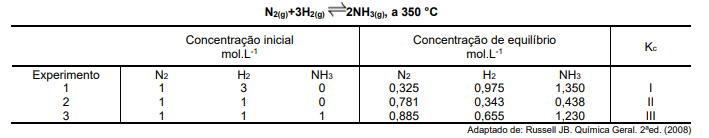
De acordo com a equação a seguir e as informações hipotéticas da tabela apresentada, referentes a três diferentes experimentos que usaram concentrações diferentes de N2(g) e 3H2(g) na produção de 2NH3(g), a 350ºC, assinale a alternativa que apresenta a correta relação das constantes de equilíbrio (I, II, III) de concentração (Kc) entre os diferentes experimentos.
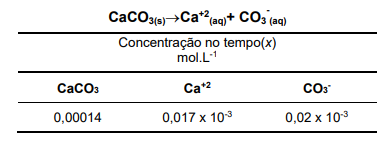
Quando um sal sólido se dissolve formando seus íons constituintes em solução, é possível medir o seu produto de solubilidade (Kps) no estado de equilíbrio. Observe a equação a seguir e as informações hipotéticas da tabela apresentada a respeito do produto de solubilidade do CaCO3 em água a 25°C e assinale a alternativa correta. Considere Kps de CaCO3 a 25ºC igual a 3,4×10-9.
O gás amônia, perigoso aos seres humanos, é de uso comum nas indústrias alimentícias, petroquímicas e metalúrgicas com várias aplicações. Mesmo exigindo o uso adequado de equipamentos de proteção individual e procedimentos de segurança, uma indústria teve o gás amônia recentemente citado em um vazamento de gás que levou centenas de seus funcionários a procurar atendimento médico com sintomas característico de intoxicação. A respeito da produção do gás amônia apresentado na equação a seguir, assinale a alternativa que apresenta o volume do gás NH3 obtido a partir de 12 L de N2(g).
Considere todos os gases nas condições normais de temperatura e pressão (CNTP).
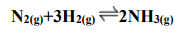
Qual a concentração em mol.L-1 de uma solução obtida pela dissolução de 750 mg de cloreto de potássio (KCl) em 500 mL de água destilada?
(Dados: massa atômica K=39,1; Cl=35,5)
Correlacione as cadeias carbônicas apresentadas a seguir com as suas respectivas classificações.
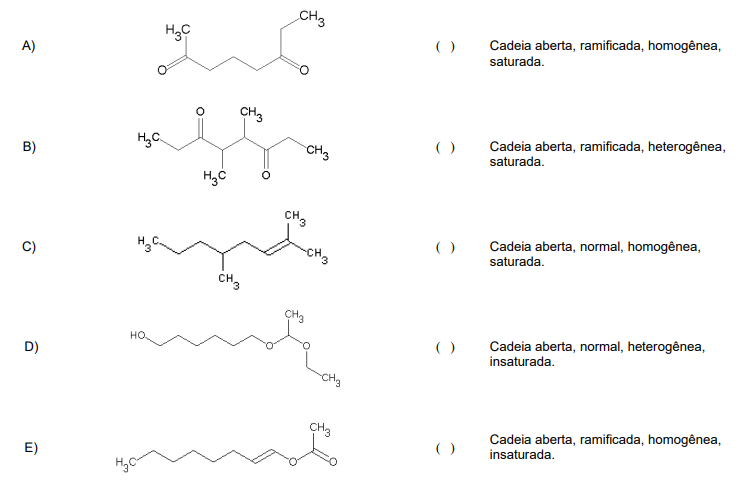
A sequência correta, de cima para baixo, é:
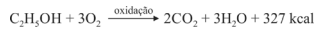
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g
Ocorrendo acidentalmente o derramamento de pequena quantidade de um hidrocarboneto líquido derivado de petróleo sobre a bancada de trabalho, deve-se de imediato
O forno mufla opera em temperaturas de 1000°C a 1200°C, sendo utilizado no laboratório para calcinar substâncias. Assim, ao utilizá-lo, deve-se evitar
Dispõe-se em estoque de um frasco contendo HC2H3O2 concentrado (massa molar 60,05 g·mol-1, densidade 1,05 g·cm-3 e % p/p 99,5) e deseja-se preparar 1 litro de solução 0,1N desse ácido. O volume, em mL, do ácido concentrado que deve ser utilizado no preparo dessa solução é
Uma amostra de volume “a" mL de solução de um ácido monoprótico foi titulada com solução 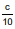 molar de uma monobase, usando-se como indicador a fenolftaleína. O ponto de viragem foi observado quando foram consumidos “b" mL da solução titulante. Então, a concentração normal da solução titulada (Nt) pode ser expressa por
molar de uma monobase, usando-se como indicador a fenolftaleína. O ponto de viragem foi observado quando foram consumidos “b" mL da solução titulante. Então, a concentração normal da solução titulada (Nt) pode ser expressa por
Entre os ácidos inorgânicos, cujas fórmulas são citadas, o único classificado como diácido é o

