O peagâmetro (ou pHmetro) é o equipamento mais comumente empregado nos métodos potenciométricos de análise e, provavelmente, o instrumento de medida química mais usado no mundo. A respeito da calibração e do funcionamento de peagâmetro de bancada, assinale a alternativa correta.
Soluções contendo ácido acético (CH3COOH) e acetato de sódio (CH3COONa) frequentemente são empregadas como solução tampão. Assinale a alternativa que apresenta o valor de pH de uma solução que contém 0,5mol.L-1 de ácido acético e 0,5mol.L-1 de acetato de sódio. Considere a constante de ionização do ácido = 4,76.
(Dados: log 1= 0)
Em um estudo recentemente publicado, elevadas concentrações de metais foram encontradas nas águas do Rio Doce, após o rompimento da barragem do Fundão. Níquel, cobre e alumínio foram encontrados nessas amostras, respectivamente, em concentrações aproximadamente 43, 86 e 47 vezes maiores que os valores máximos permitidos (VMP), de acordo com a legislação brasileira. Considerando os limites descritos na tabela a seguir, assinale a alternativa que representa a concentração desses metais, em ppm, encontrada nas amostras analisadas.

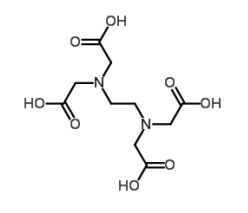
A respeito da molécula do ácido etilenodiaminotetracético (EDTA), um importante agente titulante complexométrico, é correto afirmar que:
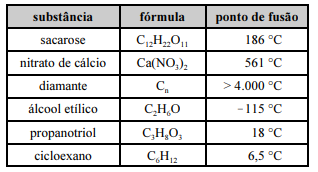
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
As ligações intermoleculares predominantes na sacarose a 25 °C são as ligações covalentes.

Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
A partir de 18 °C, uma mistura de partes iguais em massa de propanotriol e cicloexano se torna homogênea.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
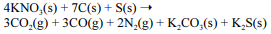
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
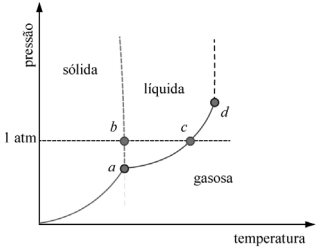
A figura precedente mostra um diagrama de fase para uma substância pura que exibe três fases: sólida, líquida e gasosa. Com base nessas informações, julgue o item subsecutivo.
O ponto c na figura representa o ponto normal de ebulição da substância em questão.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
As moléculas NH3 e BH3 apresentam diferentes geometrias moleculares.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A dissolução do gás carbônico na água para formação de água gasosa se dá pela interação entre as moléculas de H2O e CO2, por meio de forças intermoleculares do tipo dipolo-dipolo.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução que contenha íons Cd2+ na concentração 1,0 × 10-5 mol/L, uma concentração de íons S2- igual a 1,0 × 10-20 mol/L será suficiente para iniciar a precipitação do CdS.
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH -] e pKb = -log Kb, julgue o seguinte item.
Uma solução-tampão constituída por NH4C
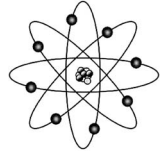
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A partir das localizações do selênio (Se) e do enxofre (S) na tabela periódica, é possível concluir que o ácido selenídrico (H2Se) possui acidez mais elevada do que o ácido sulfídrico (H2S).

A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Os elementos metálicos caracterizam-se por apresentarem elevadas afinidade eletrônica e energia de ionização.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação seja alcançado mais rapidamente; quando alcançado, o equilíbrio estará mais deslocado para o sentido dos produtos.

