Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Na proteção com metal de sacrifício, o material a ser protegido
é conectado como ânodo de uma célula galvânica, sendo o
cátodo um metal mais ativo que se consome à medida que
protege o material.
O lapachol, uma substância amarela conhecida desde 1858, é responsável pela resistência apresentada pelo ipê a cupins. É tão abundante na madeira dos ipês que, pelo simples corte, já é possível observá-la, na superfície cortada. Sua principal atividade biológica está relacionada à ação antineoplásica contra tumores cancerígenos sólidos.
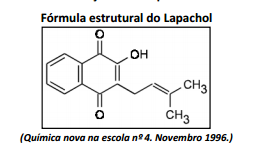
A partir da fórmula estrutural do lapachol, analise as afirmativas.
I. Possui massa molar de, aproximadamente, 242 g/mol.
II. Possui fórmula molecular C15H14O3.
III. Possui em sua estrutura as funções orgânicas fenol e éster.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Sabe-se que a massa molar do PVC pode atingir 1500000 g/mol. Costuma-se utilizar o PVC para produzir tubulações, discos fonográficos, pisos e capas de chuva. Uma de suas principais características é o fato de que ele evita a propagação de chamas, sendo usado como isolante elétrico. Esse polímero é obtido a partir de sucessivas adições de
O plástico verde pode ser produzido com etileno obtido do
álcool da cana-de-açúcar. Em particular, o etileno é obtido a
partir do álcool via reação de
A espectroscopia de absorção UV-vis permite determinar a
concentração de espécies que sofrem transições eletrônicas
quando absorvem nessa faixa de energia. Com relação a
esse assunto, assinale a alternativa correta.
Em uma aula-prática de Ciências, com a turma dividida em
grupos, foram utilizados indicadores ácido-base fabricados em
laboratório para identifi cação de quais substâncias eram ácidas
ou básicas. A professora chamou a atenção para o fato de que
esses indicadores podem ocorrer espontaneamente na natureza.
Um exemplo dessa ocorrência é:
O Modelo Atômico de Bohr foi o primeiro a aplicar o conceito
de quantização da energia e contribuiu decisivamente para a compreensão
da estrutura atômica. Segundo esse modelo, quando um
elétron absorve energia sufi ciente, é promovido a um estado ou
nível eletrônico (n) de maior energia (estado excitado ou ativado).
Ao retornar ao estado fundamental, emite ondas eletromagnéticas
(radiação). Suponha que o elétron do átomo de hidrogênio, no estado
fundamental, absorve energia, sendo promovido para o quarto
nível de energia. O comprimento de onda da radiação emitida pelo
elétron, ao retornar ao estado fundamental, em nanômetros (nm),
é aproximadamente igual a:

Clorobenzeno (C6H5Cl) e bromobenzeno (C6H5Br) formam
soluções ideais. A 100ºC, a pressão de vapor do bromobenzeno
é de 137 mmHg e a do clorobenzeno é de 285 mmHg. Considere
uma solução contendo 30,0% em massa de bromobenzeno em
clorobenzeno a esta temperatura. A pressão de vapor da solução,
em mmHg, é aproximadamente igual a:

A atividade biológica de compostos quirais pode variar muito
de um enantiômero para outro. O caso mais célebre ocorreu com a
talidomida, que causou defeitos congênitos (teratogênese) em fetos
de grávidas que fi zeram uso de medicamentos contendo misturas
de seus isômeros ópticos, cujas estruturas estão indicadas a seguir:
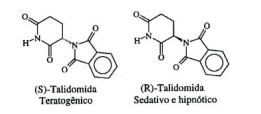
Considere um medicamento que continha um excesso enantiomé–
rico de 50%, em relação ao isômero (R). Pode–se afi rmar, então,
que a composição percentual da mistura era igual a:
Ernest Rutherford (1871–1937) foi quem descobriu que, se um núcleo radioativo se desintegra emitindo uma partícula α ou β, o núcleo resultante é, em regra, também radioativo e, mais cedo ou mais tarde, acaba expulsando alguma partícula para converterse em outro núcleo, e assim por diante, até terminar num núcleo estável, isto é, não radioativo. Considere o nuclídeo urânio–238 que, após uma série de emissões, transforma–se no chumbo–206. A quantidade de partículas alfa e beta emitidas nesta série radioativa é, respectivamente, igual a:
Uma mistura gasosa, formada por 1,00 mol de H2O(g) e 1,00 mol de CO(g) é colocada num reator de 10,0L, a 520ºC. A reação H2O(g) + CO(g) ↔ CO2(g) + H2 (g) se processa e verifica–se que, após o equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520ºC, é aproximadamente igual a:
A determinação da concentração de cátions numa solução
pode ser feita através da titulação com um ânion específico, cujos
respectivos sais dos cátions sejam pouco solúveis, mas com solubilidades
distintas entre si, na técnica de “precipitação seletiva".
A ordem de precipitação de carbonatos numa titulação sobre uma
solução contendo concentrações iguais a 0,001 mol.L–1 de Ba2+,
Mn2+, Ag+ e Zn2+ será, do primeiro para o último:

O fosfato aquoso pode ocorrer em soluções desde muito ácidas até muito alcalinas. Com relação ao assunto, numere
a coluna da direita (condições de acidez/alcalinidade) de acordo com sua correspondência com a coluna da esquerda
(fórmulas de fosfato)
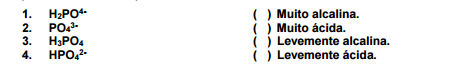
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
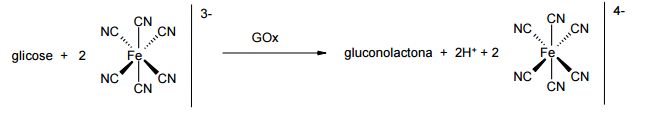
Os medidores de glicose digitais são dispositivos bastante difundidos e essenciais para pessoas que têm diabetes. Esses dispositivos são baseados em sensores de glicose, cujo teor é medido por meio de uma reação química. Uma proposta se baseia na seguinte reação: Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3-) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4-). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra. Com base no exposto, identifique como verdadeiras (V ) ou falsas (F ) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose. Assinale a alternativa apresenta a sequência correta, de cima para baixo.
Lagos, lagoas e tanques têm a qualidade da água comprometida pelo recebimento de água da chuva ou de afluentes carregados de detritos, principalmente quando esses afluentes alteram a aeração da água desses corpos. A fim de avaliar as condições de cinco lagos, foram monitoradas as espécies químicas presentes. Na tabela ao lado são mostradas informações das espécies químicas que apresentaram teores bastante elevados.
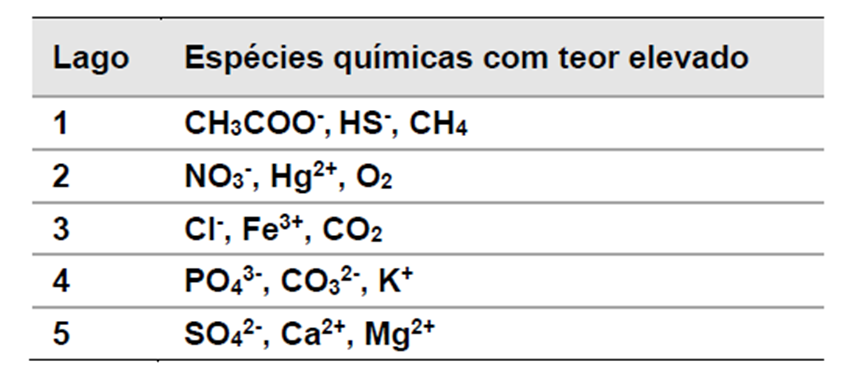
Com base no exposto, é correto afirmar que o lago que possui condição anaeróbica é o de número: