Um estudo da Universidade Federal de Minas Gerais mostra que é possível reduzir muito os arrotos das 211 milhões de cabeças do rebanho brasileiro. Com melhor pasto e suplementação alimentar, o gado engordaria mais e mais rápido e passaria menos tempo arrotando.
Fonte: Folha de S. Paulo, 29 de agosto de 2015.
A redução da quantidade de arrotos pode ajudar a controlar o aquecimento do planeta porque diminui a emissão de:
A solubilidade das substâncias depende da interação entre as moléculas do soluto e as do solvente, sendo importante, por exemplo, para o estudo e classificação das substâncias. Sobre o tema, é correto afirmar:
A entalpia H, definida por H = U + PV, onde U é a energia interna, P é a pressão e V o volume do sistema, pode ser calculada em aquecimentos isobáricos a partir da relação dH = cP.dT, onde cP é o calor específico a pressão constante. É uma propriedade termodinâmica útil em cálculos de escoamento, por exemplo em um calorímetro de fluxo. Nesse equipamento, uma corrente líquida a uma temperatura conhecida é aquecida por uma resistência elétrica até vaporizar, sendo todo o processo a P constante. Em um determinado experimento, um líquido a 100 oC recebe 2200 J/g, gerando vapor saturado a 150 oC. Sabendo que o cP do líquido é de 2,6 J/goC, a entalpia de vaporização do líquido é:
Por meio de pesquisas em vários livros, os alunos descobriram
que as substâncias podem ser de três tipos: iônica, molecular ou
metálica. As substâncias gasosas nas condições ambientais são
moleculares. São propriedades gerais dos gases moleculares:
Inúmeras reações químicas ocorrem a todo instante nas
células do nosso organismo e necessitam de um pH adequado
para que possam acontecer. Para impedir variações bruscas no
pH, o organismo lança mão das soluções-tampão. Uma das mais
eficazes é:
Uma célula galvânica é montada com um eletrodo consistindo
de uma lâmina de zinco metálico imersa em solução aquosa 1,0
mol.L–1 de sulfato de zinco. O outro eletrodo é o de hidrogênio, com
pressão parcial do gás igual a 1 bar e concentração de íons H3O+igual a 0,01 mol.L–1, a 25ºC. A força eletromotriz desta célula, em
volts, é aproximadamente igual a:
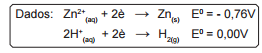
A possibilidade de estabelecimento de ligação entre dois átomos pode ser defi nida em termos de um parâmetro denominado ordem de ligação (O.L), que pode ser determinada a partir do número de elétrons em orbitais ligantes e antiligantes em diagramas de energia dos orbitais, usando–se a Teoria dos Orbitais Moleculares (TOM). Considerando o parâmetro acima citado, a associação correta entre a molécula e sua ordem de ligação está presente em:
A primeira explicação formulada para as ligações existentes
nos compostos de coordenação foi a teoria de coordenação de
Werner (1893). Esta teoria foi desenvolvida antes da descoberta
do elétron e do estabelecimento da teoria eletrônica de valência.
Considere as fórmulas de cinco complexos de metais de transição
mostradas a seguir:
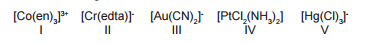
A única opção que apresenta os compostos de coordenação que
têm o mesmo número de coordenação é:

A energia reticular é defi nida como a energia necessária
para dissociar completamente um mol de um composto iônico sólido
em seus íons no estado gasoso. A magnitude da energia reticular
depende das cargas e dos raios dos íons, dentre outros fatores.
Considere os compostos iônicos mostrados a seguir:
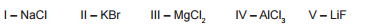
A ordem decrescente de energia reticular dos compostos é:
Algumas propriedades físicas das substâncias, como o ponto
de ebulição e a solubilidade, podem ter suas intensidades previstas
em termos das ligações intermoleculares existentes entre as
moléculas. Considere os compostos orgânicos cujos nomes estão
ordenados a seguir:
I – propan–1–ol
II – etoxietano
III – propanona
IV – propan–2–ol
V – butano
Aquele que apresenta o maior valor de ponto de ebulição é o
composto representado por:
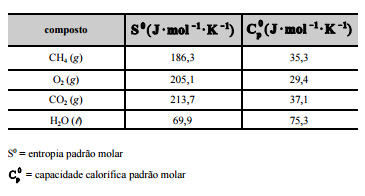
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Considerando–se que as capacidades caloríficas fornecidas na
tabela sejam válidas para o intervalo de temperaturas entre
25 ºC e 35 ºC, é correto afirmar que a combustão do CH4 (g)
deverá liberar maior quantidade de calor se for realizada a
35 ºC, e não a 25 ºC.
Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Há casos benéficos de corrosão, como a oxidação de aços
inoxidáveis, que produz uma camada protetora de óxido de
cromo, e a proteção do material de alumínio, com a formação
de óxido de alumínio.
Segundo a teoria de Arrhenius apresentada em 1887 pelo químico sueco Svante Arrhenius, como parte de sua teoria da dissociação eletrolítica, ácido é toda substância que em água produz H+. Sobre os ácidos, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Ao adicionar solução de fenolftaleína em um meio ácido a solução ficará incolor, pois o aumento da concentraçãode H+ desloca o equilíbrio.
( ) O ácido carbônico é um ácido fraco, extremamente instável, que se forma somente em equilíbrio dinâmico entre aágua e o gás carbônico.
( ) Quando reagem com o zinco produzem hidrogênio gasoso.
( ) Reagem com carbonatos e bicarbonatos para produzir monóxido de carbono.
A sequência está correta em
Com relação aos compostos químicos e às biomoléculas que
fazem parte da composição química da célula, assinale a
alternativa correta.
A cisplatina (PtC2N2H6) é um agente antineoplásico usado
extensivamente no tratamento de diversos tipos de câncer.
Em sua estrutura, os grupos cloreto e amino estão ligados
diretamente à platina, pois

