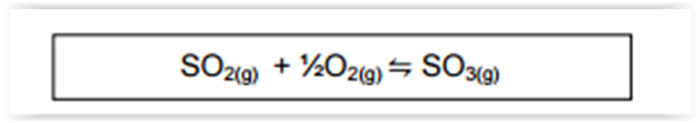A extração de petróleo em águas profundas segue basicamente três etapas: i) perfuração, utilizando uma sonda; ii) injeção de água pressurizada, que extrai o petróleo das rochas subterrâneas; e iii) separação do petróleo misturado com água e pedaços de rochas. A terceira etapa é realizada por meio dos métodos de:
Isomeria é o nome dado à ocorrência de compostos que possuem a mesma fórmula molecular, mas que apresentam estruturas diferentes entre si. Os isômeros são classificados em constitucionais, que diferem na maneira como os átomos estão conectados (conectividade) em cada isômero, e estereoisômeros, que apresentam a mesma conectividade, mas diferem na maneira como seus átomos estão dispostos no espaço. Os estereoisômeros se dividem ainda em enantiômeros, que têm uma relação de imagem e objeto (que não são sobreponíveis), e diastereoisômeros, que não têm relação imagem e objeto.
Com relação à isomeria, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.

Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
Produtores de frutas utilizam permanganato de potássio para desencadear a ireação representada pela seguinte equação:
Permanganato de potássio + Etileno → Óxido de manganês + Gás carbônico + Hidróxido de potássio
O objetivo de colocar as frutas em contato com o permanganato de potássio é:
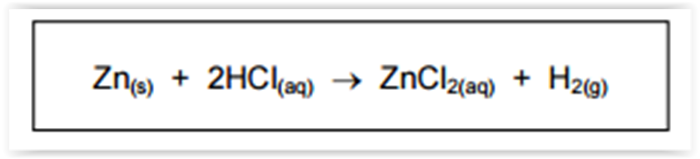
Na reação de zinco metálico (Zn(s)) com ácido clorídrico (HCl(aq)), há formação de cloreto de
zinco (ZnCl2(aq)) e gás hidrogênio (H2(g)), conforme a seguinte equação
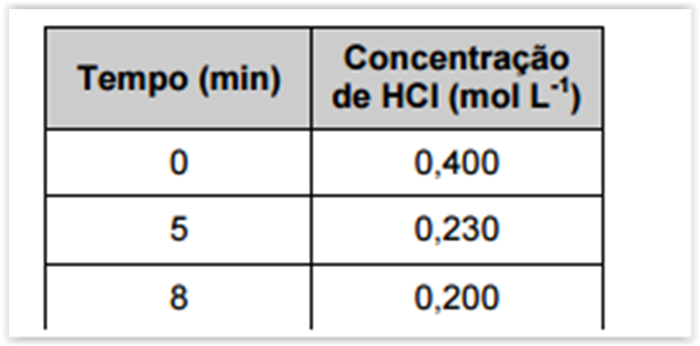
Nessa reação, o HCl é consumido e a tabela a seguir mostra a sua concentração em função do tempo.
A alternativa que apresenta o valor correto da velocidade média da reação (mol L-1 min-1) no intervalo de 5 a
8 minutos é
Analise as reações abaixo.
I. SO2 + H2O2 → H2SO4
II. SO2 + H2O → H2SO3
III. SO2 + NH4OH → NH4HSO3
Das reações, ocorre o fenômeno de oxirredução em
O fenômeno de corrosão metálica causa grandes prejuízos às indústrias, pois nesse
processo ocorre a dissolução lenta da superfície de equipamentos, quando os mesmos são expostos ao ar,
em contato com o solo ou água do mar. Com o objetivo de minimizar a corrosão do ferro em equipamentos,
são utilizados os chamados “eletrodos de sacrifício", os quais são formados por barras de outros metais,
convenientemente escolhidos que, quando colocados em contato com a superfície do equipamento, sofrem
corrosão no lugar do ferro
Com base nos dados tabelados, são considerados “eletrodos de sacrifício" adequados as barras de
Uma das etapas possíveis de formação da chuva ácida pode ser representada pelo
equilíbrio
A expressão da constante de equilíbrio KC, com base na lei de ação das massas, para esta reação é
Um volume de 10,00 mL de uma amostra aquosa de Y foi transferido com uma pipeta
volumétrica para um balão volumétrico de 100,00 mL, o qual teve seu volume ajustado até a marca de
aferição com água destilada, de modo a se ter uma solução de trabalho. Essa solução foi analisada por
Espectrofotometria UV-vis e apresentou um valor de absorbância ( A ) de 0,600 em 240 nm e caminho óptico
de 1 cm. A curva de calibração construída para a análise dessa amostra possui a seguinte equação: A =0,030C, onde C é a concentração de Y, em mg L-1
, na solução. A concentração, em mg L-1, do composto Yna amostra é
Os álcoois são compostos versáteis, e podem ser usados como material de partida para a preparação de uma grande variedade de produtos. A reação de oxidação parcial de um álcool secundário, cuja fórmula geral é dada por R2CHOH, gera como produto um(a)
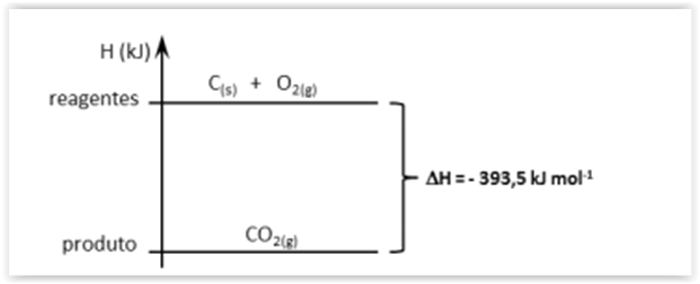
A reação de 1 mol de grafita, C(s), com 1 mol de oxigênio gasoso produz 1 mol de dióxido
de carbono gasoso. O diagrama abaixo mostra a variação de entalpia para essa reação.
Analise as afirmativas abaixo sobre essa reação.
I.A energia liberada pode ser chamada de entalpia de formação de CO2(g).
II.A energia liberada pode ser chamada de entalpia de combustão de grafita.
III.É uma reação endotérmica.
IV.Para queimar 1 mol de C(s), é necessário fornecer 393,5 kJ para o sistema.
Está(ão) CORRETA(S):
O volume de água adicionado a 50 mL de solução de hidróxido de sódio (NaOH), cuja concentração é igual a 60 g L-1 , para que seja obtida uma solução a 5,0 g L-1 , será
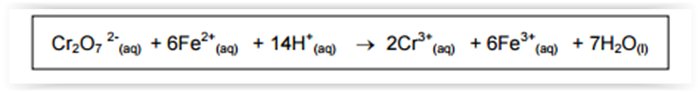
Uma amostra de 6,000 g de hematita, um mineral de ferro, foi dissolvida completamente em
ácido, e o ferro presente foi totalmente reduzido a Fe2+. A seguir, a amostra dissolvida foi transferida para
um balão volumétrico de 250,0 mL, o qual foi completado com água destilada até a marca de aferição. Uma
alíquota de 10,00 mL dessa solução contendo o Fe2+ foi titulada com exatamente 25,00 mL de uma solução
padrão 0,020 mol L-1
de dicromato, em meio ácido, segundo a equação abaixo.
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é,
aproximadamente, igual a
A técnica de espectroscopia de absorção na região do UV/visível é um método óptico de análise baseado na Lei de Beer-Lambert, a qual relaciona a absorção da radiação pelas moléculas do analito com a concentração do mesmo. Sobre a Lei de Beer-Lambert, considere as afirmações que se seguem: I.A absorbância (A ) de uma solução está relacionada com a transmitância de forma logarítmica, A=-log T. II.A absorbância é diretamente proporcional à concentração de uma espécie absorvente (c) e ao caminho óptico (b ) do meio absorvente, A=?bc. III.A constante de proporcionalidade chamada absortividade molar, à qual é dado o símbolo especial ?, é independente da natureza da espécie analisada. IV.Se a concentração é expressa em mols por litro e o caminho óptico em centímetros, então o coeficiente de absortividade molar possui as unidades de L moL-1cm-1 . Estão corretas APENAS as afirmativas
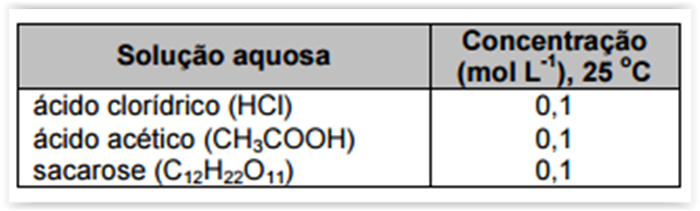
A técnica de condutometria direta pode avaliar o comportamento de soluções aquosas
quanto à condução de corrente elétrica, por meio de medidas de condutância. Essa condutância é um
resultado da soma da contribuição individual de cada íon presente na solução. A tabela a seguir mostra
diferentes tipos de soluções aquosas e suas concentrações.
Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO
afirmar:
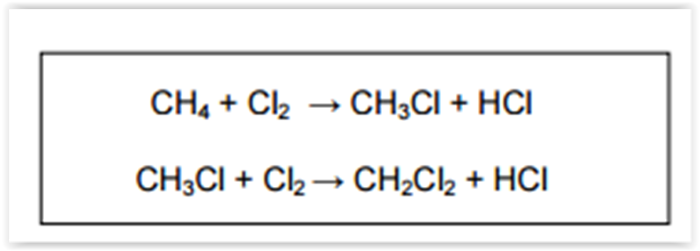
A obtenção do diclorometano (CH2Cl2), um solvente orgânico utilizado na indústria química,
ocorre em duas etapas. Na primeira etapa, o clorometano (CH3Cl) é produzido devido à reação entre o
metano (CH4) e o gás cloro. Na segunda etapa, o clorometano produzido reage com gás cloro formando o
diclorometano. Essas reações ocorrem em temperatura adequada na presença de luz e em um mesmo
reator.
As reações mostradas acima para a obtenção de diclorometano são de