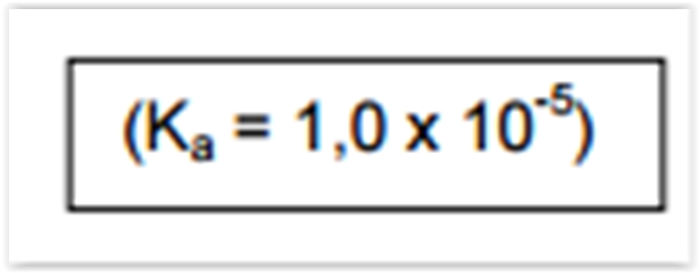A água usada no abastecimento de comunidades humanas requer padrões de qualidade. Assim, ela não deve apresentar sabor, odor e aparência desagradáveis, bem como não deve conter substâncias nocivas e micro–organismos patogênicos. Substâncias orgâ– nicas, como, por exemplo, os compostos 2–trans–6–cis–nonadienal e 3–cis–hexen–1–ol produzidos por algas, em níveis muito baixos (nanograma.L–1), causam alterações no sabor e odor. Em relação à ocorrência de isomeria nos compostos citados, é correto afi rmar que:
Uma amostra de alumínio metálico de massa 21,6 g é completamente
dissolvida em solução aquosa de ácido clorídrico e o gás
liberado na reação é coletado e colocado em um balão de 25 L, onde
a pressão era de 3,0 atm. Em seguida, o gás é aquecido até 127ºC.
Considerando o gás como ideal, a pressão dentro do balão, em atm,
após ser alcançada a temperatura, é aproximadamente igual a:

Um químico orgânico recebeu em seu laboratório uma amostra de um líquido para ser identifi cada. Os primeiros testes (cromatografi a em camada delgada, ponto de ebulição) mostraram tratar–se de uma substância pura. A amostra apresentou resultado negativo nas reações com permanganato de potássio (um agente oxidante forte) e com o reagente de Tollens (espelho de prata). No entanto, apresentou resultado positivo nos testes com iodofórmio e com 2,4–dinitrofenilhidrazina. A partir dessas informações, o tipo de substância que pode ser o líquido analisado é:
Diariamente, inúmeras situações mostram a infl uência da
temperatura na rapidez com que as reações químicas se processam.
Por exemplo, a efervescência de um comprimido antiácido é
maior em água à temperatura ambiente do que em água gelada.
Os alimentos são colocados na geladeira, pois uma diminuição
da temperatura faz com que a decomposição dos alimentos por
micro–organismos ocorra de forma mais lenta. Em um experimento,
a constante de velocidade (k) para a decomposição de primeira
ordem de um composto em solução foi determinada a várias temperaturas
(T), conforme mostra a tabela a seguir:
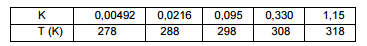
A energia de ativação para a reação de decomposição pode ser
calculada a partir da tabela e seu valor, em kJ.mol–1, é aproximadamente
igual a:
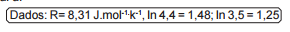
A reação de substituição nucleofílica entre o brometo de tercbutila
e o ânion hidróxido ocorre em um solvente orgânico, em duas
etapas, conforme mostrado a seguir:
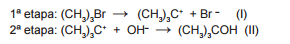
Um perfi l de reação genérico (esboçado) do processo é indicado
no gráfi co que segue:
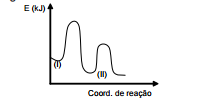
Em função dos dados fornecidos, pode–se afi rmar que o tipo de
substituição nucleofílica e a lei de velocidade da reação são, respectivamente:
Uma suspensão usada como contraste radiológico, à base
de sulfato de bário, foi contaminada acidentalmente com carbonato
de bário, o que pode causar sérios problemas, pois o carbonato se
dissolve no ácido do estômago e os íons bário são extremamente
tóxicos, podendo levar os pacientes à morte, dependendo de sua
concentração na corrente sanguínea. Para determinar o percentual
de carbonato, foram analisados 5,0 g de amostra sólida, constituída
de sulfato e carbonato de bário. Após a reação do sólido com uma
solução aquosa de ácido clorídrico, verifi cou–se a formação de um
gás, que ocupa um volume de 125 mL, a 27ºC e 1atm de pressão.
Considerando o gás como ideal, o percentual de carbonato de bário
na amostra analisada é aproximadamente igual a:

Uma amostra de 1,0 g de benzeno cuja massa molecular é
igual a 78 g.mol-1
foi queimada completamente em um
calorímetro. Sabendo-se que os produtos são apenas CO2 e
H2O e que NA é igual a 6 x 1023 mol-1
, foram consumidos
nessa reação
A respeito de cogeração, julgue o item seguinte.
A cogeração é a produção simultânea e de maneira sequenciada de duas ou mais formas de energia a partir de um combustível, sendo o processo mais comum a produção de eletricidade e de energia térmica a partir do uso de gás natural e(ou) de biomassa.
A nomenclatura de compostos inorgânicos depende dos cátions e ânions de que são formados. Os compostos HClO3, Fe(OH)2 e NaHSO3, por exemplo, têm os nomes respectivamente de:
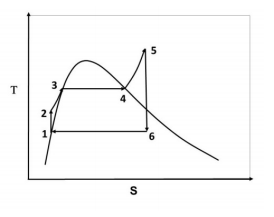
A figura ao lado representa um ciclo térmico de Rankine em um
diagrama temperatura (T ) x entropia (S ). O ciclo é composto por seis
etapas, representadas por linhas que unem os estados
termodinâmicos numerados de 1 a 6. Em relação à figura, é correto
afirmar:
Adicionar sal de cozinha ao gelo é uma prática comum quando se quer “gelar" bebidas dentro da geleira. A adição do sal faz com que a temperatura de fusão se torne inferior à da água pura.
(Dados: Kf = 1,86 ºC.kg.mol-1 ; M(g.mol-1 ): Cl = 35,5; Na = 23)
A diferença na temperatura de fusão (em °C) na mistura obtida ao se dissolver 200 g de sal de cozinha em 1 kg de água, em relação à água pura, é de:
Um dos parâmetros que caracteriza a qualidade de manteigas industriais é o teor de ácidos carboxílicos presentes, o qual pode ser determinado de maneira indireta, a partir da reação desses ácidos com etanol, levando aos ésteres correspondentes. Uma amostra de manteiga foi submetida a essa análise e a porcentagem dos ésteres produzidos foi quantificada, estando o resultado ilustrado no diagrama ao lado.

O ácido carboxílico presente em maior quantidade na amostra analisada é o:
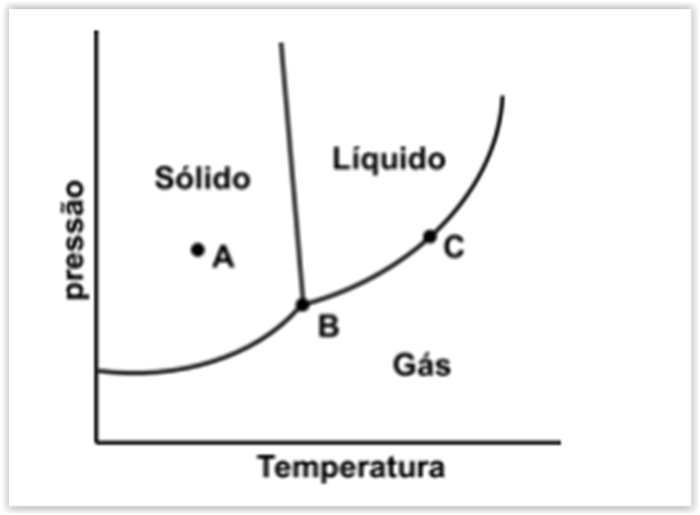
A Figura abaixo mostra um diagrama de fases de uma substância pura.
O número de fases que estão presentes em cada um dos pontos circulares identificados como A, B e C,
respectivamente, nessa figura, é
Considerando o sistema tampão formado pelo par ácido/base conjugada ácidopropanoico/íon propanoato
(CH3CH2COOH/CH3CH2COO-), calcule o valor de pH de 1,0 L de solução cuja
concentração de ácido propanoico é 0,0300 mol L-1
e de propanoato de sódio é 0,300 mol L-1. A resposta CORRETA é:
A célula eletroquímica representada pelo esquema da figura que segue, onde V é um
voltímetro e S é uma ponte salina que contém uma solução saturada de nitrato de potássio (KNO3), possui
um eletrodo de zinco imerso em uma solução de nitrato de zinco, Zn(NO3)2, e outro eletrodo de prata imerso
em uma solução de nitrato de prata, AgNO3, nas concentrações indicadas a 25ºC.
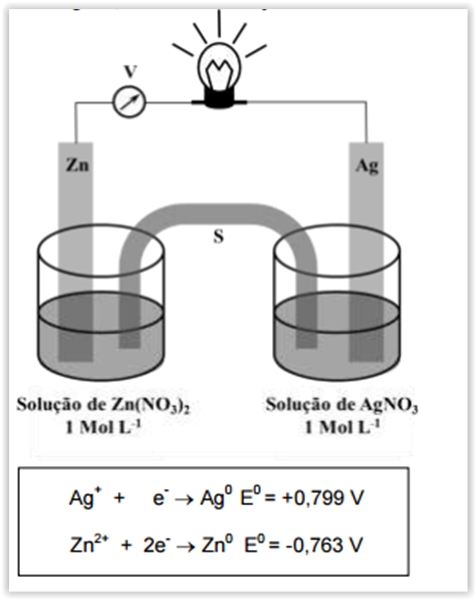
Considerando a célula eletroquímica e os potenciais-padrão de redução acima representados, é CORRETO
afirmar: