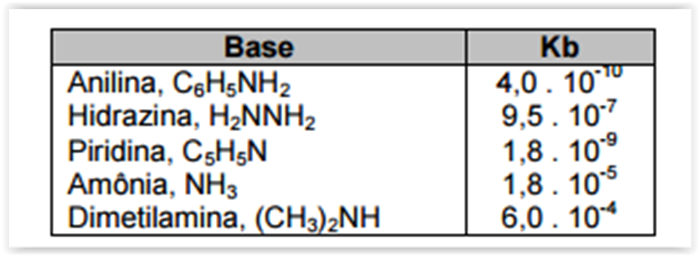
A tabela abaixo mostra os valores de constantes de dissociação, Kb, a 25 °C, para
diversas bases.
Analisando esses valores, é CORRETO afirmar:
Os instrumentos de medida empregados na Espectroscopia de Absorção Atômica (EAA) utilizam, como fonte de radiação, a lâmpada de catodo oco que emite luz IMAGEM
Um pilar de extremidades articuladas tem seção transversal quadrada de 2m de comprimento. Esta coluna é constituída de pinho com E = 13GPa e σadm = 12 Mpa para compressão na direção paralela às fibras. Usando um coeficiente de segurança de 2,5 no cálculo da carga crítica de Euler para flambagem, determinar a dimensão, em mm, da seção transversal, de modo que a coluna possa resistir com segurança a uma força de 100KN.
Uma empresa, diante da elevação dos preços da energia
elétrica e das descobertas de grandes reservas de gás de xisto nas
proximidades de suas instalações, resolveu investir na geração
própria de energia termoelétrica. O gás de xisto é composto
principalmente por metano (CH4), cuja equação de combustão é
CH4 (g) + 2O2 (g) –> CO2 (g) + 2H2O (l). A tabela a seguir mostra
os dados termodinâmicos, a 25 ºC, relativos aos compostos
envolvidos na equação apresentada.
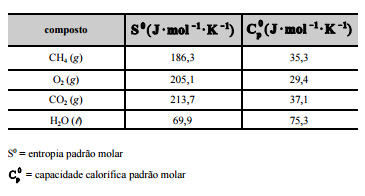
Com relação a essa situação hipotética, julgue os itens
subsequentes, considerando que a combustão do CH4 ocorra de
forma completa; que a entalpia padrão de combustão do CH4 (g), a
25 ºC, seja igual a –890 kJ/mol; e que as massas molares, em g/mol,
do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
Se o consumo mensal de energia elétrica da referida empresa
for de 1,0 × 1012 J, a combustão do CH4 (g), sob pressão
constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
CO2 para suprir as necessidades mensais de energia da
empresa.
Uma célula eletroquímica realiza a eletrólise de uma solução aquosa
de NaCR operando com uma corrente constante de 100,0 A e com
rendimento de 100% para a formação de Cl2. Considerando que a
massa molar do Cl2 seja igual a 70,9 g/mol e que a constante de
Faraday seja igual a 96.500 g/mol, julgue os próximos itens.
Na eletrólise da solução aquosa de NaCR, a formação do Cl2
ocorre no ânodo da célula.
O etileno ― o alceno mais simples e um dos mais importantes
produtos orgânicos fabricados industrialmente ― é utilizado na
síntese de polietileno, de etanol, de ácido acético e de outros
compostos. O polietileno é um dos polímeros mais versáteis
existentes no mercado. A respeito das matérias–primas e de aspectos
relacionados à produção de etileno (eteno) e de polietileno, julgue
os itens a seguir.
A principal diferença entre os processos de polimerização de
etileno sob alta pressão e sob baixa pressão está na utilização,
por este último, de um sistema catalítico.
A intensidade das forças intermoleculares em diferentes substâncias varia em uma grande faixa, mas essas forças são muito mais fracas que as ligações iônicas e covalentes. Dessa forma, é necessário menos energia para vaporizar um líquido ou fundir um sólido do que quebrar ligações covalentes em moléculas.
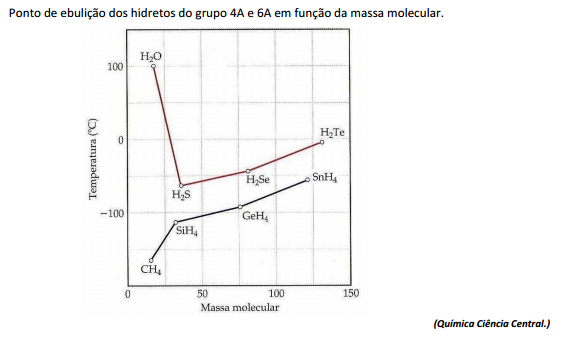
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
Reação química é uma transformação em que novas substâncias
são formadas a partir de outras. Em sua sala de aula, a
professora utilizou, como evidência de que está ocorrendo alguma
reação química, algumas pistas como:
O peróxido de hidrogênio (H2O2) é muito usado em reações
de óxido–redução (ou redox), já que pode atuar como agente
oxidante ou redutor. É vendido comercialmente na forma de soluções aquosas de diferentes concentrações. Em uma análise para
determinar a concentração de uma amostra, 5,10 g de uma água
oxigenada comercial foram diluídos com água até 250 mL. Uma
alíquota de 25 mL da mesma solução foi titulada por uma solução
básica de cloreto de cromo III (CrCl3), conforme a equação não
balanceada abaixo:
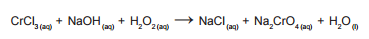
Sabendo que foram gastos 50,00 mL de solução básica de CrCl3
de concentração 0,01 mol.L–1, a porcentagem em massa (% m) de
peróxido de hidrogênio na amostra de água oxigenada é igual a:
As Leis da Termodinâmica explicam as variações de energia e a tendência de ocorrência dos processos de modo espontâneo, sendo essenciais para a compreensão da Química. Considerando, por exemplo, um processo que é exotérmico, em relação à espontaneidade, à variação de entropia (ΔS) e à temperatura, pode–se afirmar que:
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida
em HCl e completou–se o volume até 100,00 mL de solução.
Uma alíquota de 25,00 mL foi transferida para um balão, seguida
da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3
Um excesso de KBr foi adicionado para formar Br2, segundo a
equação a seguir:
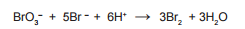
O bromo formado reage com toda a sulfanilamida presente no antibiótico
e, após um tempo, é adicionado excesso de KI, para reagir
com o excesso de bromo, formando Isub>2. Finalmente, o iodo formado é
titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1
de tiossulfato de sódio. As demais equações químicas são:
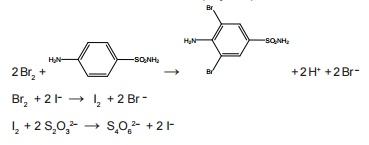
A porcentagem de sulfanilamida presente na amostra do antibiótico
em pó é aproximadamente igual a:

O álcool benzílico (ou fenilmetanol) é um álcool aromático líquido. É utilizado como componente de fragrâncias e aromas, como preservante para produtos oftálmicos, injetáveis e orais, sendo também usado como solvente e como um produto químico intermediário para reações orgânicas. A reação do álcool benzílico com uma solução aquosa básica de permanganato de potássio produz um composto A que, após purifi cação, reage com excesso de etanol, sob catálise ácida, formando um produto orgânico B, também de aplicação industrial, cujo nome é:
A análise elementar quantitativa de 2,035 g de um composto
orgânico oxigenado X forneceu 4,840 g de CO2 e 2,475 g de H2O,
por combustão. Verifi cou–se também que a referida massa de X
ocupa um volume de 1,1275 L, a 227ºC e 1atm de pressão. Dentre
todos os possíveis isômeros, X é o único que possui enantiômeros.
O número total de isômeros (constitucionais e estereoisômeros)
com a fórmula molecular em questão e o nome do composto X
estão respectivamente indicados em:
Considere a sequência de reações mostrada a seguir:
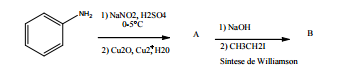
A fórmula estrutural correta do composto B é:
O carbeto de alumínio, quando hidrolisado, gera gás metano segundo a reação mAl4C3 + nH2O → oCH4 + pAl(OH)3, onde m, n, o e p são os coeficientes estequiométricos. Assinale a alternativa que contém o conjunto de valores m, n, o e p respectivamente que deixa a reação balanceada.