O ácido benzoico tem entalpia padrão de combustão igual a
–3227 kJ.mol–1. Para calibrar um calorímetro, foram usados 2,27 g
deste ácido, aumentando em 5,0ºC a temperatura do calorímetro.
Em seguida, com o calorímetro a 25ºC, promoveu–se a queima
de 1,6 g de acetileno (etino) e a temperatura subiu para 31,7ºC. A
entalpia padrão de combustão do acetileno, em kJ.mol–1, é aproximadamente
igual a:

Um dos experimentos mais realizados em aulas de laboratório
de química para alunos do ensino médio é descrito a seguir.
Em um erlenmeyer é feita a combustão do enxofre; ao produto dessa
reação, adiciona–se água e obtém–se uma substância A, que torna vermelho
o papel azul de tornassol. Em outro erlenmeyer, faz–se a combustão do
magnésio, adiciona–se água e obtém–se uma substância B, que torna azul
o papel vermelho de tornassol. Em seguida, promove–se a reação entre A
e B, formando uma substância C, em meio aquoso.
O nome da substância C é:
Soluções “tampão" são sistemas químicos muito importantes
na Medicina e Biologia, visto que muitos fl uidos biológicos necessitam
de um pH adequado para que as reações químicas aconteçam
apropriadamente. O plasma sanguíneo é um exemplo de um meio
tamponado, que resiste a variações bruscas de pH quando se
adicionam pequenas quantidades de ácidos ou bases. Considere
uma solução “tampão" preparada pela adição de 100 mL de solução
0,01 mol.Lsup>–1 de ácido acético a 100 mL de solução 0,1 mol.L–1 de
acetato de sódio. O pH deste “tampão" é aproximadamente igual a:

A Daptomicina é um lipopeptídeo cíclico isolado do fungo
Streptomyces roseosporus, que apresenta elevada atividade sobre
bactérias resistentes. Este antibiótico foi recentemente aprovado
pelo US–FDA para tratamento de infecções cutâneas graves, sendo
comercializado pelo nome de Cubicin. Sua estrutura é mostrada
a seguir:
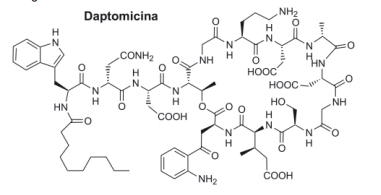
Algumas das funções orgânicas presentes na estrutura da Daptomicina
são:
Em 2008, o Brasil foi o terceiro maior extrator de bauxita
(minério) no mundo, o quarto maior produtor de alumina (óxido
de alumínio) e o sexto maior produtor de alumínio metálico. A obtenção
do metal a partir do óxido é feita por eletrólise ígnea, após
a separação da alumina das impurezas através do “processo de
Bayer", que é a reação com soda cáustica. Em seguida, ocorre a
adição de “criolita", um mineral que atua como fundente, diminuindo
o ponto de fusão de 2072ºC para cerca de 1000ºC. Finalmente,
ocorre a eletrólise, com eletrodos (não inertes) de grafi te (C). Um
processo eletrolítico de alumínio ocorre durante 12h, utilizando uma
corrente de 100 ampères (A). A massa aproximada, em gramas,
de metal obtido no cátodo e a substância produzida no ânodo são,
respectivamente:

Em relação a tipos de material e ao processo de corrosão, julgue os
próximos itens.
Considerando os potenciais de oxidação mostrados a seguir, é
correto afirmar que a limpeza de aço inoxidável com cloro
pode ser recomendada por impedir a corrosão devido ao menor
potencial de oxidação (E) do ferro (Fe) em relação ao cloro
(Cl).
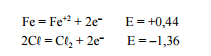
Para preparar três soluções no laboratório: Pb(NO3)2 a 0,1 mol/L; CaCl2 a 0,5 mol/L; e, NaCl a 2 mol/L, deve-se pesar quanto de cada sal, respectivamente? (Dados: massa atômica: Pb = 207; O = 16; Na = 23; N = 14; Cl =35,5; e, Ca = 40.)
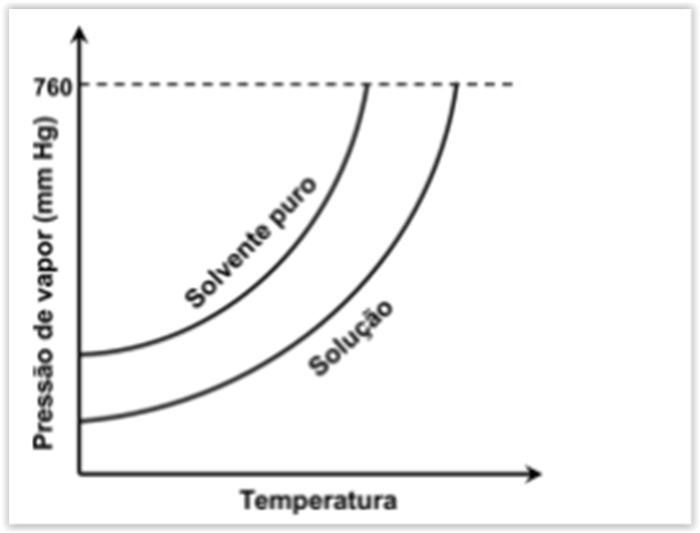
Considere o gráfico da pressão de vapor em função da temperatura, para um solvente puro
e para uma solução desse solvente contendo um soluto molecular não volátil.
A partir do gráfico, é CORRETO afirmar:
Um volume de 500 mL de uma solução 1,0 mol L-1 de cloreto de sódio (NaCl) foi misturado a 1.500 mL de uma outra solução 2,0 mol L-1 de NaCl, completando-se com água até atingir o volume final de 2.500 mL. A concentração, em mol L-1 , da solução resultante é
A tabela a seguir fornece os valores de pH ou pOH de soluções.
A respeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
A quantidade de carbono em um composto orgânico foi determinada através da queima de 0,2121 g do composto em um fluxo de oxigênio. O CO2 produzido na reação foi coletado em uma solução de hidróxido de bário. Se 0,6000 g de BaCO3 foi formado, a porcentagem de carbono na amostra é
A técnica de cromatografia é utilizada para separação, identificação e quantificação de componentes químicos em misturas complexas. Essa técnica se baseia na distribuição de substâncias entre duas fases químicas ou físicas, sendo uma fase estacionária e a outra fase móvel ao longo do sistema. Com relação aos diferentes tipos de técnicas cromatográficas, é INCORRETO afirmar:
Compostos orgânicos são classificados conforme o grupo funcional que compõe a molécula. Por exemplo, os compostos CH3CHCH2, CH3CHO e CH3CH2OCH2CH3 são, respectivamente:
Preparou-se uma solução 0,05 molar de uma base fraca em água. O pH da solução foi medido a 25 oC, resultando no valor 11. Sabendo que um mol da base, quando dissociado, gera dois mol de OH- , é correto afirmar que a porcentagem da base que sofreu dissociação é:
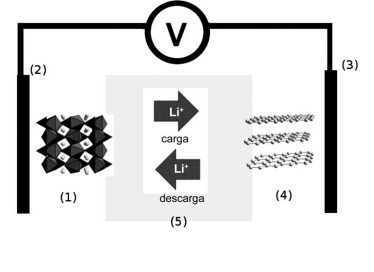
No passado, as cargas das baterias dos celulares chegavam a durar até uma semana, no entanto, atualmente, o tempo entre uma recarga e outra dificilmente ultrapassa 24 horas. Isso não se deve à má qualidade das baterias, mas ao avanço tecnológico na área de baterias, que não acompanha o aumento das funcionalidades dos smartphones. Atualmente, as baterias recarregáveis são do tipo íon-lítio, cujo esquema de funcionamento está ilustrado na figura ao lado. Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente: