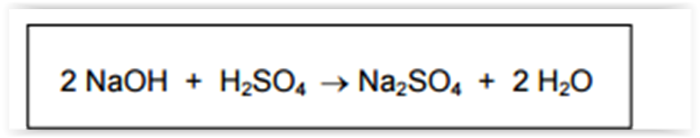A fenolftaleína é um indicador de pH que pode ser usado no
teste de Kastle-Meyer para detecção de vestígios de sangue.
O teste só é possível, porque a fenolftaleína em contato com
o sangue
Considere uma solução tampão composta por um ácido HA e um sal de íon comum BA, em água. Em relação a essa solução, é INCORRETO afirmar:
Considere um líquido em um balão de vidro, sendo agitado por meio de um agitador mecânico. Estima-se que a potência que o agitador transmite ao líquido é de 60 W. Após cinco minutos de operação, a partir da medida da temperatura do líquido, observa-se que a sua energia interna está 8000 (oito mil) joules maior. Nessas condições, é correto afirmar que a energia que saiu do sistema em forma de calor é de:
Das reações químicas abaixo, qual delas é conhecida como desnitrificação?
Diferentes líquidos, em função da sua tensão superficial, apresentam volumes de gota diferentes. A tabela abaixo mostra o número de gotas contido em 1 mL para três líquidos diferentes:
Um grupo de amigos percebe que, ao se gotejar um líquido sobre uma moeda, forma-se uma gota sobre essa moeda. Após adições sucessivas, a gota colapsa e o líquido espalha-se sobre a moeda. No entanto, eles verificam que, dependendo do líquido, o comportamento é diferente, mas o material da moeda não influencia. Assim, eles fazem um desafio para ver quem consegue utilizar o menor volume de líquido para cobrir toda a superfície da moeda, sendo que eles podem escolher entre os líquidos A, B e C e utilizar uma moeda de 5 ou 10 centavos. Quem ganhou o desafio?
Considere um recipiente fechado de paredes rígidas, com volume constante de três litros,
contendo um mol de gás ideal a uma pressão de 5 atm e 0 °C. Quando esse sistema é aquecido até uma
temperatura de 273 °C, a pressão, em atm, do gás dentro do recipiente deverá ser:
A equação abaixo representa a reação de neutralização entre hidróxido de sódio (NaOH) e
ácido sulfúrico (H2SO4).
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1
que reage com 0,5 mol de NaOH é:
A solução concentrada de ácido perclórico (HClO4) possui densidade de 1,70 g mL-1 e 70 % de pureza. Para preparar uma solução diluída de ácido perclórico, mediu-se um volume de 5,00 mL da solução concentrada e diluiu-se para 250 mL em um balão volumétrico, completando-se o volume com água destilada. A concentração final, em mol L-1 , dessa solução diluída foi
Em um laboratório de análises químicas, solicitou-se ao técnico o preparo e a padronização
de soluções de hidróxido de sódio (NaOH) e ácido clorídrico (HCl), ambas na concentração de 0,1 mol L-1
.
Dessa forma, o técnico procedeu a pesagem da massa de NaOH calculado em um béquer e dissolveu em
água destilada, agitando com o auxílio de um bastão de vidro. Transferiu a solução para um balão
volumétrico e completou-o com água até a marca da aferição. Posteriormente, mediu um volume adequado
de solução concentrada de ácido clorídrico e transferiu para um balão volumétrico preenchido parcialmente
com água destilada, completando o volume com água até a marca da aferição. A padronização da solução
de NaOH foi feita por titulometria, utilizando biftalato de potássio como padrão. Em seguida, o técnico
utilizou essa solução padronizada para descobrir a concentração verdadeira da solução de HCl, também por
titulometria. Analisando esse procedimento, é CORRETO afirmar:
O Cr de uma superfície cromada de dimensões 3,00 x 5,00 cm foi dissolvido em ácido clorídrico. O pH da solução foi ajustado e, posteriormente, foram adicionados 15,00 mL de solução padrão de EDTA 0,200 mol L-1 . O reagente em excesso foi retrotitulado com um volume de 4,00 mL de solução padrão de Cu2+ 0,100 mol L-1 . A massa aproximada, em mg, de Cr em cada centímetro quadrado da superfície foi
Os métodos potenciométricos de análise se baseiam em medidas do potencial de células eletroquímicas na ausência de correntes apreciáveis. O potencial medido está relacionado com a composição química dos eletrodos e das soluções nas quais estão submersos. Considerando as características desses métodos, analise as afirmativas que se seguem. I.O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II.A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III.A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação. É CORRETO
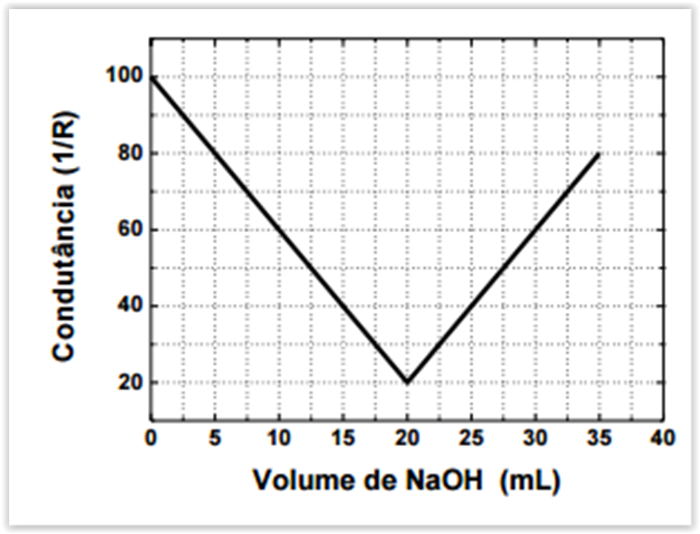
Em uma titulação condutométrica, uma amostra de 5 mL de HCl foi titulada com NaOH 0,10 mol L-1
padrão. A partir do gráfico de condutância vs. volume de solução de NaOH adicionado na
titulação, é CORRETO afirmar que a concentração, em mol por litro, da solução de HCl titulada é
As utilidades do bicarbonato de sódio (Na HCO3) estão relacionadas
com as reações de dupla troca. Esta substância tanto pode
ser usada em fermentos, extintores de incêndio e como antiácidos
estomacais. No estômago, o bicarbonato age:
O Índio e o Tálio são os elementos naturais mais pesados do grupo 13 da classifi cação periódica. O Alumínio é o elemento mais conhecido e abundante deste grupo, tendo suas propriedades químicas dominadas pelo estado de oxidação +3, ou seja, forma o íon Al3+. Entretanto, o Índio e oTálio apresentam frequentemente o estado de oxidação +1. A tendência a formar íons com carga duas unidades menor que a usual para o grupo também é verifi cada entre os elementos mais pesados dos grupos 14 e 15, sendo conhecida pelo nome de:
A reação de aldeídos e cetonas com ilídeos de fósforo, conhecida como Reação de Wittig, conferiu o prêmio Nobel de Química de 1979 ao alemão Georg Wittig, que a realizou em 1954. Desde então, tem sido um método muito usado para a síntese de: