Considere que a relação entre a massa atômica (A) e o número atômico (Z) de um elemento X seja estabelecida pela expressão A = 2Z + 1 e que os últimos cinco elétrons do elemento X ocupem orbitais 2p. Nessa situação, é correto afirmar que X é isótono do átomo
Texto 1A6
A fumaça contém uma variedade de compostos orgânicos, como o metano (CH4), o brometo de metila (CH3Br), o metanal (CH2O) e o dissulfeto de carbono (CS2). Metais e metaloides,como o césio (Cs), o chumbo (Pb), o arsênio (As) e o antimônio (Sb), além de estarem presentes na fumaça, muitas vezes são encontrados também em águas e superfícies contaminadas. A exposição crônica a essas substâncias aponta a necessidade de avaliação quanto à implementação de estratégias de segurança laboral que promovam a proteção dos bombeiros.
Barros et al. Biomonitoring of firefighting forces: a review on biomarkers
of exposure to health-relevant pollutants released from fires.
In: J. Toxicol. Environ. Health B Crit. Rev. 2023, n.º 3,
p. 127-171 (em livre tradução e com adaptações).
Com base nas informações apresentadas no texto 1A6, sabendo que ZAs = 33, ZSb = 51, ZCs = 55 e ZPb = 82, que o Cs pertence ao
grupo 1A da tabela periódica, que o Pb pertence ao grupo 4A, que o As e o Sb pertencem ao grupo 5A, que o As está no 4.º período, que Sb está no 5.º período e que o Cs e o Pb estão, ambos, no 6.º período, é correto afirmar que a ordem crescente de energia de ionização é
O chumbo é classificado como um metal pesado, altamente tóxico e muito nocivo aos seres humanos. Seu símbolo, Pb, tem origem na palavra latina Plumbum, que significa prata líquida, e seu número atômico é 82.
O número de níveis que esse elemento possui e a quantidade de elétrons em sua camada de valência são, respectivamente:
A teoria atômica acreditou por muito tempo que o átomo é a menor parte da matéria. Contudo, hoje sabe-se que o átomo
pode ser dividido entre prótons, nêutrons e elétrons, que por sua vez podem ser divididos em outras partículas, conhecidas como partículas subatômicas.
Sobre os constituintes de um átomo, assinale a alternativa incorreta.
![]()
As ideias sobre os átomos e sua composição passaram por diversas modificações ao longo dos anos. A partir de estudos, foram propostos alguns modelos que explicariam de que seria formada a menor parte que constitui a matéria. Analise a seguir os modelos propostos e seus respectivos cientistas responsáveis:
I. O átomo é uma esfera maciça, indestrutível e que pode ser dividido - Dalton
II. O átomo é uma esfera maciça de carga positiva encrustada de elétrons - Thomson
III. O átomo possui um núcleo positivo, com elétrons girando ao seu redor – Rutherford
A correlação entre o cientista e suas ideias está correta
A eletronegatividade é uma propriedade de cada elemento ligada a força com que determinado elemento pode atrair elétrons para próximo de si. Essa propriedade afeta a distribuição eletrônica nas substâncias químicas.
Sobre a eletronegatividade e distribuição, eletrônicas assinale a alternativa correta.
O elétron é uma partícula subatômica, com carga elétrica negativa representado pelos símbolos e− ou β−. Considera-se que os elétrons são partículas elementares, pertencentes a primeira geração da família dos léptons. A massa do elétron é aproximadamente 1/1836 da massa do próton (1 u). O elétron tem propriedades quânticas que incluem um momento angular intrínseco (spin) fracionário, o que significa que é um férmion e, portanto, dois elétrons não ocupam o mesmo estado quântico (princípio da exclusão de Pauli). Os elétrons podem ser descritos quanticamente por quatro números quânticos, assinale a alternativa que descreve estes quatro números quânticos.
Um ânion cloreto (Cl–) tem 17 prótons e 18 nêutrons e um cátion sódio (Na+) tem 11 prótons e 12 nêutrons. Quantos elétrons terão o Cl– e o Na+, respectivamente?
A energia dos orbitais atômicos, dentre outros fatores, está relacionada com a capacidade de interação dos elétrons com o seu núcleo. Em um dado átomo polieletrônico, observa-se experimentalmente por medidas espectroscópicas que o orbital 2s possui energia menor que o orbital 2p. Esse comportamento pode ser compreendido observando o gráfico abaixo de probabilidade radial para os orbitais 1s, 2s e 2p.
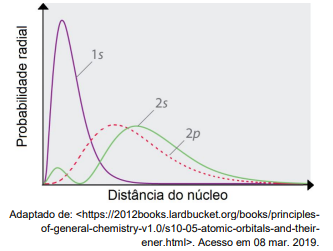
Sendo assim, analise as afirmações a seguir e assinale a alternativa correta:
I. Os orbitais 2s e 2p são degenerados.
II. Os orbitais 2s têm uma maior capacidade de penetração do que os orbitais 2p.
III. Os orbitais 2p são menos blindados pelos elétrons dos orbitais 1s, quando comparados aos orbitais 2s.
IV. Um átomo com configuração eletrônica terminada em ns¹ tem menor energia de ionização quando comparado a um outro átomo com configuração eletrônica terminada em ns²np¹.
Isótopos radioativos de oxigênio foram utilizados em dois experimentos. No primeiro, foram utilizados para marcar moléculas de dióxido de carbono, enquanto no segundo, esses isótopos foram utilizados para marcar moléculas de água. Em ambos os experimentos, as moléculas marcadas com o isótopo radioativo foram fornecidas a plantas para a realização da fotossíntese.
Após a utilização das moléculas marcadas, pode-se afirmar que os seguintes resultados foram obtidos:
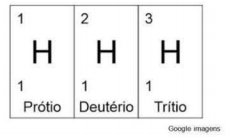
Observe a imagem a seguir.
Com base na imagem dos elementos acima podemos classificá-los como:
Considerando‐se a seguinte reação, que envolve íons do átomo de cobre (6329Cu) : Cu2+ (aq) + e− → Cu+ (aq), assinale a
alternativa que apresenta, correta e respectivamente, o número de prótons, elétrons e nêutrons da espécie iônica de cobre produto dessa reação.
Identifique a família e o período da Tabela Periódica nos quais está localizado um elemento cujos números quânticos para o elétron mais energético do cátion bivalente são: n = 5, l = 2, m = +2, s = + ½. Considere s = s = - ½ para o primeiro elétron no orbital.
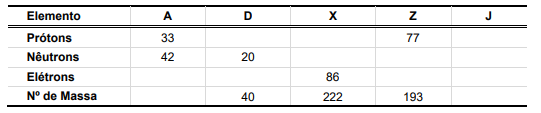
O avanço nas técnicas de análises de espécies químicas diversas permite o descobrimento de fenômenos importantes, como o ocorrido com a espectrometria de massas, técnica que permitiu identificar que átomos de um mesmo elemento podem apresentar massas diferentes. Essa observação foi definitiva para o refinamento do modelo nuclear, com a descoberta de uma nova partícula subatômica – o nêutron – e a identificação de isótopos. Considere a seguinte tabela:
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
A configuração eletrônica do átomo de ferro Fe e seu íon Fe (III) são, respectivamente,
Dado: número atômico do Fe= 26