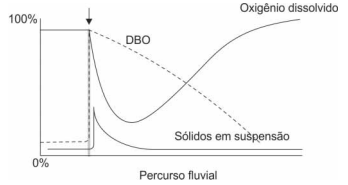
A determinação dos sólidos que constituem todas as substâncias que permanecem na cápsula após a total secagem de um determinado volume de amostra de água, em estufa (105 ± 2 °C) até peso constante, refere-se aos sólidos
Considere a ilustração abaixo.
O evento indicado pela seta representa:
A determinação do OD (oxigênio dissolvido) na água pode ser feita por meio do método Winkler. Nesse método, o OD é fixado através da adição de sulfato de manganês(II), em meio alcalino. Em seguida adicionam-se íons iodeto e o meio é acidificado, ocorrendo liberação de iodo que é titulado com solução de tiossulfato de sódio. Em uma análise de controle, foram coletados 200 mL de água e, após o tratamento preliminar, de acordo com o método Winkler, titulou-se a amostra com solução de Na 2S2O3 0,01 mol/L, consumindo-se 8,0 mL desse reagente. A concentração do oxigênio dissolvido, em mg/L, nessa amostra é
Dados:
1 mol de O2 equivale a 4 mols de Na2S2O3 no método Winkler
Massas molares (g/mol):
Na = 23
S = 32
O = 16
A massa de cobre metálico, em gramas, que será depositada no cátodo de uma célula eletrolítica contendo solução de CuSO 4, submetida a uma corrente de 2,0 Amperes, durante 10 minutos, considerando rendimento eletrolítico de 100%, é igual a
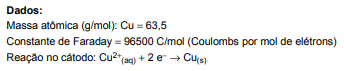
Considere as duas soluções aquosas ácidas apresentadas a seguir:
I. Ácido sulfúrico (H2SO4), um ácido forte (α = 100%), 0,1 mol/L.
II. Ácido acético (CH3COOH), um ácido fraco (α = 10%), 0,1 mol/L.
O pOH do ácido sulfúrico e o pH do ácido acético são respectivamente
Considere a seguinte sequência de sais de sódio: tiossulfato, sulfeto, sulfato e sulfito. Assinale a opção que corresponde à correta sequência das fórmulas desses sais.
Com relação aos elementos químicos 21Sc e 34Se, assinale a afirmação verdadeira.
O odor e o sabor do etanoato de 3-metilpentila são semelhantes aos da banana, e os do propanoato de isobutila, aos do rum. Assinale a opção que apresenta correta e respectivamente suas fórmulas moleculares, função orgânica a que elas pertencem e o tipo de isomeria constitucional existentes nessas substâncias.
Mesmo que um modelo atômico consiga explicar muitos fenômenos ele não explica tudo o que acontece, e pode ser substituído. Em se tratando de modelos atômicos analise as proposições abaixo:
I. O modelo de Dalton foi um resgate da primitiva teoria atômica de Epicuro que viveu entre 341 a.C. e 270 a.C.
II. Rutherford postulou que o átomo era uma esfera maciça de carga positiva com cargas negativas incrustadas na superfície.
III. O modelo de Bohr repousava na mecânica clássica e explicava perfeitamente a existência de órbitas estacionárias.
IV. O modelo atual foi concebido com as contribuições de De Broglie, Heisenberg e Schrödinger.
V. O número quântico spin foi introduzido por Wolfgang Pauli para explicar a descoberta da duplicação das raias espectrais.
Está correto o que se afirma somente em
Na República de Camarões, os lagos Nyos e Monoun emitem periodicamente nuvens de gás carbônico que matam diretamente por asfixia milhares de pessoas que habitam a uma distância de até 42 quilômetros. Essa letalidade se deve ao fato de que
Uma solução é preparada dissolvendo 4,8 kg de um composto de massa molar desconhecida em 120 g de água e tem o ponto de congelação de –1,50 °C. Considerando a constante crioscópica da água igual a 1,86 °C kg H2O/mol do soluto, a massa molecular do composto formado é

Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
O sulfeto de sódio é um sólido molecular.

Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
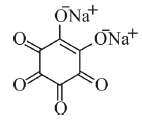
Considere que na reação do bário com o rodizonato de sódio, mostrado na figura a seguir, haja apenas troca de cátions para gerar a coloração laranja. Nessa situação, para formar o composto rodizonato de bário, serão necessários mais de 1.000 μg de rodizonato de sódio para reagir totalmente com 1.306,5 μg de nitrato de bário.
Na figura a seguir, quatro cubas eletrolíticas (I, II, III e IV) contendo soluções aquosas de mesma concentração foram ligadas em série, funcionando sob mesmas condições e durante igual período de tempo.
Sabendo-se que os eletrodos são inertes em todas as cubas, é correto afirmar que em
O álcool benzílico é usado como solvente geral para tintas, lacas e revestimentos, a base de resinas epóxi. A reação desse álcool com uma solução aquosa ácida de permanganato de potássio produz um composto I que, após purificação, reage com excesso de etanol, sob catálise ácida, formando um produto orgânico II, também de aplicação industrial.
Os nomes dos compostos I e II são, respectivamente,