O reativo de Fehling consiste na mistura de duas soluções, contendo sulfato de cobre (solução A) e tartarato duplo de sódio e potássio em meio alcalino (solução B), e é largamente empregado para a determinação de carboidratos. O método fundamenta-se na reação entre o cobre e o açúcar redutor da amostra, e em análise titrimética, a titulação é efetuada com a amostra na bureta e as soluções de Fehling, em ebulição, em erlenmeyer sob aquecimento contínuo. Ao final da titulação, forma-se um precipitado vermelho-tijolo. O reativo de Fehling deve ser previamente padronizado com solução de glicose de concentração conhecida para estabelecer a relação com a quantidade de glicose na amostra. Acerca dessa metodologia, assinale a alternativa correta.
1) Considerando que o precipitado vermelho formado corresponde ao óxido cuproso (Cu2O), pode-se dizer que o cobre sofreu redução.
2) Para a manutenção do aquecimento do reativo de Fehling, pode ser empregado o conjunto bico de Bunsen e placa de amianto.
3) Sabendo-se que na padronização o licor de Fehling reagiu com 0,0490 g de glicose, pode-se dizer que há essa mesma quantidade de glicose na massa total da amostra em análise.
Está(ão) correta(s), apenas:
O captopril foi aprovado para uso pelo FDA (Agencia Reguladora Norte-Americana) em 1980, e representa o fármaco protótipo de uma série de novos agentes anti-hipertensivos, com suas estruturas representadas a seguir. A partir da análise dessas estruturas, é possível identificar a parte da molécula presente no protótipo ( I ) também presente nos demais compostos (II, III e IV). Assinale a alternativa que indica a função orgânica contida na parte comum a todas as estruturas e outra função orgânica que pode ser encontrada em todas as moléculas representadas, respectivamente.

A centrífuga é o equipamento utilizado em laboratório para separar
Considere a reação química a seguir
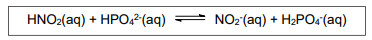
De acordo com a teoria ácido-base de Bronsted-Lowry, nessa reação o
Abaixo estão representados cinco frascos contendo soluções aquosas diluídas dos compostos indicados.
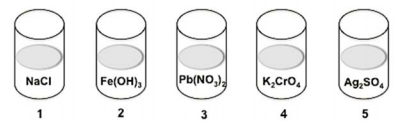
Gotejando solução de HCl 1M sobre cada uma dessas cinco soluções, haverá a formação de precipitado somente nos frascos
Observe a equação química a seguir.
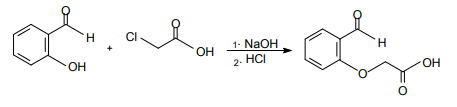
O produto formado é um composto que apresenta os grupos funcionais característicos das funções orgânicas
Considerando que a solubilidade do acetato de sódio é igual a 123,5g / 100g de água a 20°C, no que se refere à dissolução do soluto, é correto afirmar que
Uma caixa vazia com capacidade de 10 L de volume encontra-se em um ambiente cuja pressão é 1 atm e a temperatura 25ºC.

Um técnico injeta 1 mol de H2(g) e, logo em seguida (sem retirar esse gás), injeta mais 1 mol de He(g). Em relação ao volume em litros do H2(g), do He(g) e da mistura gasosa dentro da caixa, é CORRETO afirmar:
O tipo de interação/ligação representada no esquema e apontada por uma seta é:

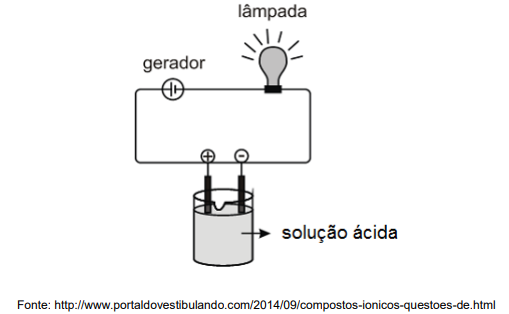
A lâmpada apresentará um brilho mais intenso se a solução tiver como soluto:
Que volume de solução se obtém ao diluir uma solução de concentração 25 g/L de NaHCO3 para 10 g/L utilizando 30 L de água pura?
Um estudante realizou quatro experimentos:
Em I, adicionou um comprimido efervescente inteiro em água a 25ºC.
Em II, adicionou metade de um comprimido efervescente em água a 25º C.
Em III, adicionou um comprimido efervescente inteiro em água a 90ºC.
Em IV, adicionou metade de um comprimido efervescente em água a 90º C.

O copo em que a dissolução do comprimido foi mais rápida e os fatores que a justificam estão devidamente corretos é:
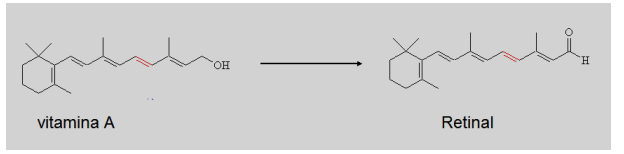
A reação de transformação da vitamina A em retinal, tão importante no mecanismo da visão, é uma reação de
O tratamento da água de captação superficial envolve várias fases. Entre elas podemos citar:
• Oxidação
• Coagulação
• Floculação
• Decantação
• Filtração
• Desinfecção
• Correção de pH
• Fluoretação
Alguns materiais são utilizados nessas fases, entre eles: cloro, sulfato de alumínio e cloreto férrico.
A utilização desses materiais ocorre nas seguintes fases, respectivamente:
Oxigênio dissolvido é a concentração de oxigênio (O2) contido na água, sendo essencial para todas as formas de vida aquática. Os sistemas aquáticos produzem e consomem oxigênio, o qual é retirado da atmosfera na interface água – ar. O oxigênio é obtido, também, como resultado de atividades fotossintéticas de algas e plantas. A quantidade de oxigênio presente na água em condições normais depende da temperatura, da quantidade de sais presentes e da pressão atmosférica. A solubilidade dos gases aumenta com a diminuição da temperatura e diminui com o aumento da salinidade.
Uma determinada lagoa sofreu uma única descarga de efluente de uma pequena fábrica. O oxigênio dissolvido foi monitorado durante 10 dias e um gráfico gerado a partir da coleta de água logo após o despejo do efluente.
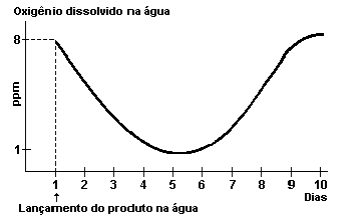
Em relação ao gráfico apresentado, NÃO se pode afirmar que, em relação ao efluente lançado,

