O metanol líquido pode ser obtido a partir da reação de síntese entre monóxido de carbono e gás hidrogênio. As entalpias de formação das substâncias citadas são, respectivamente, -238,4 kJ.mol-1 e -110,5 kJ.mol-1 .
O valor da variação de entropia da vizinhança desse sistema a 25°C, em J.K-1, é:
A anilina é um composto nitrogenado que contém um anel benzênico e cuja fórmula molecular é C6H7N.
Com base nessa informação, conclui-se que a anilina é um(a)
As propriedades físicas e químicas de compostos químicos de uma mesma classe diferem na medida em que as suas moléculas se tornam maiores e mais complexas.
Por exemplo, ao compararmos o metano (CH4), etano (C2H6), hexano (C4H10) e decano (C10H22), é observado que o(a)
Considere os procedimentos de laboratoristas abaixo. I - Usar jaleco fechado, de manga longa e com comprimento abaixo do joelho. II - Usar lentes de contato. III- Aquecer o líquido volátil em recipiente fechado e de vidro. IV - Rotular todos os frascos de reagentes. V - Dispensar o uso de óculos de segurança após terminar a sua manipulação de reagentes. Quais são procedimentos adequados para um laboratorista lidando com solventes orgânicos?
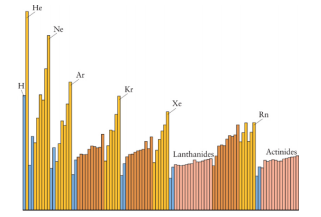
Considere a figura abaixo que apresenta a variação de uma propriedade periódica em função do número atômico.
De acordo com a tendência geral das propriedades periódicas, a propriedade apresentada na figura acima poderia ser
Bases de Schiff, ou iminas, são compostos obtidos através da reação de desidratação entre moléculas que contenham o grupo carbonila, como aldeídos ou cetonas, e moléculas que contenham a função amina. Um esquema da formação de uma base de Schiff é
Considerando que as diferentes substâncias são formadas por diferentes formas de combinação de átomos dos elementos químicos, assinale a opção correta.
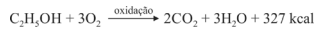
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de 109 kcal.
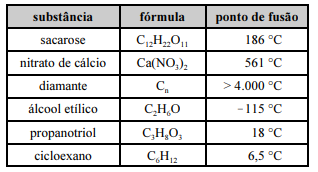
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
O nitrato de cálcio é um exemplo de sólido iônico, formado por íons, mas que apresenta ligações covalentes na sua estrutura.

Considere as reações I, II e III a seguir.
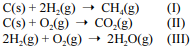
Com relação a essas informações, julgue o item que se segue.
De acordo com as leis das reações gasosas de Gay Lussac, sob mesma temperatura e pressão, o volume ocupado pelo CO2 é maior que o volume do O2 na reação II.
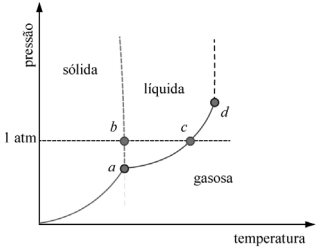
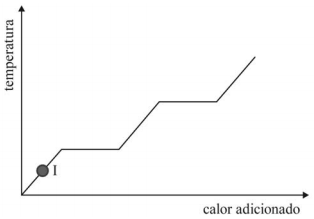
A figura precedente mostra um diagrama de fase para uma substância pura que exibe três fases: sólida, líquida e gasosa. Com base nessas informações, julgue o item subsecutivo.
O ponto b indicado na figura precedente está corretamente localizado e representado pelo ponto I na curva de aquecimento seguinte.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A concentração de íons S2- em uma solução aquosa de H2S 0,100 mol/L é inferior a 1,0 × 10-10.
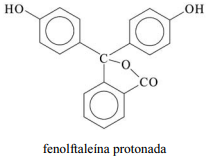
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
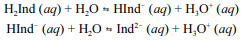
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A molécula de fenolftaleína protonada apresenta as funções fenol e éster.

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
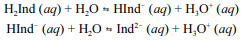
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
Considerando que a fenolftaleína seja incolor em pH reduzido e rosa em pH elevado, infere-se que a forma protonada da fenolftaleína é a que apresenta coloração rosa.
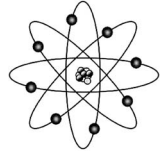
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A razão de os elementos químicos emitirem um espectro descontínuo de energia (espectros de linhas) é que, conforme proposto por Rutherford, os prótons ocupam uma região central muito pequena, denominada núcleo, ao passo que os elétrons se localizam em uma região extranuclear de dimensões muito maiores.