A calibração de equipamentos, instrumentos e vidrarias de uso rotineiro no laboratório é essencial para as análises químicas. A respeito da calibração do material volumétrico, assinale a alternativa correta.
Frequentemente as análises titrimétricas são empregadas, ainda na atualidade, para determinação de inúmeras substâncias, pois são consideradas métodos relativamente baratos, com baixo custo unitário por determinação. A respeito desses métodos, assinale a alternativa correta.
O pH das soluções é um parâmetro que influencia diretamente as análises químicas e deve ser observado cuidadosamente. Nesse sentido, a cromatografia líquida de alta eficiência no modo reverso emprega, frequentemente, fases móveis aquosas constituídas de soluções tampão. A esse respeito, assinale V para as afirmações verdadeiras, ou F para as falsas.
( ) Variações de pH afetam as análises cromatográficas, pois podem levar a significativas mudanças no estado de ionização e solubilidade de muitas moléculas após interferência no equilíbrio ácido-base das reações.
( ) Na cromatografia, uma solução tampão é escolhida como fase móvel para aumentar a precisão analítica, pois o tampão resiste a mudanças de pH, mesmo que grandes quantidades de ácidos ou bases sejam adicionados.
( ) O pH da solução tampão independe da sua diluição, uma vez que a concentração de cada componente da solução tampão varia proporcionalmente com uma variação de volume. Assim, na cromatografia no modo reverso, o ideal é preparar um tampão concentrado e dilui-lo quantas vezes forem necessárias, para otimizar a fase móvel.
( ) A capacidade tamponante aumenta à medida que a razão entre as concentrações do ácido e da base conjugada se torna maior ou menor que a unidade. Assim o pKa do ácido escolhido dever estar entre ± 1 unidade do pH desejado na solução, para que o tampão tenha uma capacidade razoável.
A sequência correta, de cima para baixo, é:
A incorporação de íons fluoreto torna os dentes menos susceptíveis ao surgimento de cáries, e por essa razão o fluoreto de sódio (NaF; 41,98 g.moL-1) é usado na fabricação de cremes dentais e enxaguantes bucais e, em muitas cidades, é adicionado à água tratada, para o consumo humano (água fluoretada). Considerando que um creme dental e um enxaguante bucal apresentam em sua composição 1450 ppm e 210 ppm de fluoreto de sódio, respectivamente, assinale a alternativa que representa a massa total de fluoreto de sódio contida em uma embalagem de 90 g desse creme dental e a concentração percentual de fluoreto de sódio no enxaguante bucal.
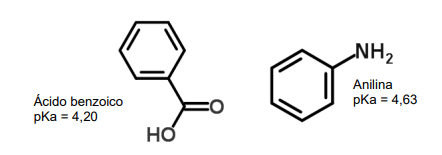
O ácido benzoico (C7H6O2) e a anilina (C6H7N) representados a seguir, são, respectivamente, um ácido fraco e uma base fraca. Considerando os valores de pKa fornecidos, assinale a alternativa que apresenta as espécies predominantes esperadas para essas substâncias em solução com pH 7,0.
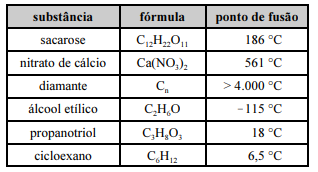
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Os sólidos moleculares são razoavelmente macios, têm pontos de fusão baixos a moderados e apresentam baixa condução térmica.

Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Dado que viscosidade é a resistência que um líquido apresenta para fluir, o propanotriol é mais viscoso que o álcool etílico.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
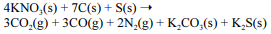
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato de potássio e o cátion do nitrato de alumínio é maior que 250,0 g/mol.

Considere as reações I, II e III a seguir.
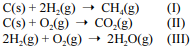
Com relação a essas informações, julgue o item que se segue.
A substituição de 1, 2 ou 3 átomos de hidrogênio por átomos de cloro na molécula de metano tornaria polares todos os compostos formados, contudo, caso os 4 átomos de hidrogênio na molécula de metano fossem substituídos por átomos de cloro, a molécula formada seria mantida apolar, como o próprio metano.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A energia de ligação entre os átomos de flúor em uma molécula de F2 é maior que a energia de ligação entre os átomos de nitrogênio em uma molécula de N2.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
O ponto de ebulição do etanal (CH3CHO) é maior que o ponto de ebulição do éter dimetílico (CH3OCH3).
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução aquosa de H 2S, a ordem decrescente de concentração das espécies presentes é [H2O] > [H3O+] > [H2S] > [S2-] > [HS-].
A solubilidade dos sulfetos depende fortemente do pH do meio. Por esse motivo, muitas vezes a precipitação desses compostos é realizada em meio tamponado. Considerando que pOH = -log [OH -] e pKb = -log Kb, julgue o seguinte item.
A solubilidade de um sulfeto metálico é tanto menor quanto maior for a acidez do meio.
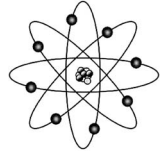
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A proposta de existência de órbitas com trajetórias bem definidas para os elétrons de um átomo, conforme ilustrado na figura, mostrou-se, mais tarde, ser um equívoco, visto que os elétrons apresentam propriedades de ondas e, portanto, não podem ser descritos como partículas com trajetórias bem definidas.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
Se a reação de desidratação de um alqueno ocorre de acordo com uma cinética de pseudoprimeira ordem, então o gráfico da concentração do alqueno em função do tempo terá aspecto conforme indicado no gráfico a seguir.


