Em uma disciplina de química medicinal, os alunos foram instruídos a acompanhar o roteiro de aula prática descrito a seguir.

Qual(is) equipamento(s) de proteção individual (EPI) ou coletiva (EPC) não é(são) necessário(s) à realização dessa prática?
Ácidos e bases são rotineiramente usados nos experimentos de química. Caso não sejam manuseados e armazenados adequadamente, constituem um importante fator de risco no ambiente de laboratório. A respeito dos cuidados com o manuseio, armazenamento e descarte desses produtos químicos e seus resíduos, assinale a alternativa correta.
A medida precisa de massa é um fator imprescindível para as análises químicas atuais, e pode ser feita com o auxílio de balanças analíticas modernas. A respeito da instalação, operação e cuidados no uso da balança analítica, assinale a alternativa correta.
As análises gravimétricas podem ser consideradas métodos analíticos quantitativos clássicos, mas ainda na atualidade são empregadas para diversas finalidades. Nesse contexto, assinale a alternativa correta.
O CO2 é constantemente produzido no corpo por processos metabólicos intracelulares. No sangue, o CO2 dissolvido reage com a água, formando ácido carbônico. Rapidamente, o ácido carbônico dissocia-se em íons H+ e HCO3–. No organismo, o tampão bicarbonato constituído pelo par HCO3– e CO2 é o de maior importância fisiológica e envolve de maneira integrada os pulmões, o sangue e os rins. Considerando a ação tamponante desse sistema, que acontece segundo as reações descritas a seguir e a possibilidade de ocorrência de distúrbios do equilíbrio ácido-básico, analise as sentenças abaixo.
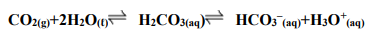
1) Caso ocorra maior produção de ácidos no organismo, decorrente de alguma situação patológica, por exemplo, o equilíbrio será deslocado para a esquerda, com maior produção de CO2 que será eliminado pelos pulmões.
2) Em indivíduos com dificuldades respiratórias e, portanto, maior quantidade de CO2 acumulado no organismo, pode acontecer deslocamento do equilíbrio, com elevação do pH fisiológico.
3) O consumo excessivo de bases, como os medicamentos antiácidos, por exemplo, pode ocasionar deslocamento do equilíbrio, e, em casos extremos, provocar o abaixamento do pH fisiológico.
Está(ão), correta(s), apenas:
A estimativa de que 70-75% da população mundial podem ser intolerantes à lactose (C12H22O11) levou a uma maior procura por produtos livres desse dissacarídeo naturalmente presente no leite e seus derivados. Esse cenário tem contribuído não apenas com o recente interesse das indústrias de alimentos no desenvolvimento de novos produtos com baixo teor de lactose, mas também impulsionou a recente regulamentação quanto à declaração obrigatória da presença de lactose nos alimentos com mais de 100 miligramas (mg) de lactose para cada 100 gramas ou mililitros do produto. Nesse contexto, assinale a alternativa que apresenta aproximadamente o número de mols de lactose presente em 100 mL de um produto com baixo teor de lactose, contendo 2500 mg de C12H22O11.
(Dados: massas atômicas C=12, H=1, O=16)
Para um procedimento de neutralização ácido-base, foi solicitada a adição de um determinado volume de uma solução de hidróxido de sódio 0,5 mol.L-1 em uma solução de ácido acético 1 mol.L-1. Entretanto, para esse procedimento, o laboratório dispõe apenas de uma solução estoque de hidróxido de sódio 2 mol.L-1. Nesse contexto, assinale a alternativa que apresenta o volume de solução de hidróxido de sódio 2 mol.L-1mL necessário para preparar 50 mL da solução de hidróxido de sódio 0,5 mol.L-1.
A água boricada é uma solução não estéril que contém água e ácido bórico (H3BO3) e é comercializada em drogarias, normalmente, nas concentrações de 2% e 3%. Qual a massa de ácido bórico 3% em uma embalagem de 250 mL?
Aldeídos e cetonas são classes de compostos orgânicos com algumas características comuns. A respeito desses compostos, assinale a alternativa correta.
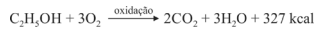
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Álcool etílico hidratado é uma mistura homogênea.
Todas as propriedades macroscópicas das substâncias, ou seja, que a gente pode observar a olho nu, são definidas pelo tipo de ligação que ocorre microscopicamente entre os átomos. A natureza destas ligações depende da estrutura eletrônica dos átomos. Mas você deve estar se perguntando, por que os átomos se ligam?
Assim como os seres humanos, os átomos também procuram estabelecer ligações com outros átomos para adquirir mais segurança ou estabilidade, formando por meio dessas ligações as moléculas ou os cristais.
A molécula nada mais é do que um grupo de átomos unidos por ligações químicas. Sabemos, por exemplo, que o gás hidrogênio é formado por dois átomos do elemento hidrogênio (H2) e que a água é formada por dois átomos de hidrogênio mais um átomo de oxigênio (H2O).Com base neste contexto considere o elemento X do terceiro período da tabela periódica forma com o magnésio o composto MgX e, com o hidrogênio, H2X. O número de elétrons da última camada de X é:
Assinale a alternativa em que a regra empírica de “o semelhante dissolve o semelhante” está corretamente expressa.
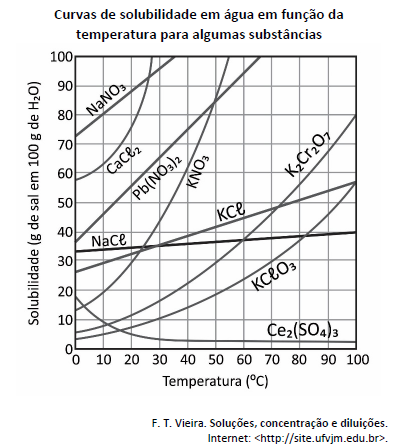
Considerando‐se as massas molares (g mol−1): O = 16; K = 39,1; e Cr = 52 e o gráfico apresentado, a quantidade de matéria aproximada, em mol, de dicromato de potássio contida em 1,3 kg de uma solução saturada desse sal a 50 ºC é igual a
Com relação a essa organização de agregados moleculares, a formação de micelas ocorre porque os(as)
Ácidos e bases são substâncias essenciais em diversas aplicações da química. Para uma aula experimental, foram utilizadas duas soluções, uma de ácido sulfúrico (H2SO4) 0,01 mol L−1, e outra de hidróxido de potássio (KOH) 1,30 mol L−1. Para o experimento, foram misturados 100 mL da solução ácida e 10 mL da solução básica, sendo analisado o comportamento da reação.
Com base nessa situação hipotética, assinale a alternativa que apresenta o valor do pH da solução formada após a realização da mistura.