Um laboratorista recebeu as soluções resultantes de uma aula experimental contendo cátions Ba2++ e Cd2+. Para realizar o descarte correto do resíduo o laboratorista decidiu tratá-lo. Indique, qual dos procedimentos listados a seguir, é o mais adequado para tratamento do resíduo.
Estudos cinéticos da reação 2NO + O2 → 2 NO2 mostraram que quando a concentração inicial de O2 é dobrada e a concentração de NO é mantida constante, a velocidade da reação dobra; quando a concentração inicial de NO é dobrada e a de O2 é mantida constante, a velocidade inicial quadruplica. Qual será o incremento da velocidade inicial da reação quando as concentrações iniciais de O2 e de NO forem triplicadas?
Os símbolos de risco são pictogramas utilizados em rótulos ou informações de produtos químicos. Eles servem para lembrar o risco envolvido ao se manusear do produto. A seguir são apresentados alguns símbolos de risco e precauções.

Assinale a alternativa que contenha a sequência que apresenta a correta associação dos símbolos de risco com suas respectivas orientações de precaução.
Dissolução de amostras é uma técnica básica comumente empregada nos laboratórios de química. Para determinadas amostras, utiliza-se uma mistura, em volume, de 75% de ácido clorídrico com 25% de ácido nítrico, que resulta em uma solução com alto poder oxidante. Para dissolução de silicatos, pode-se utilizar um determinado ácido. A solução oxidante e o ácido, anteriormente descritos, são, respectivamente:
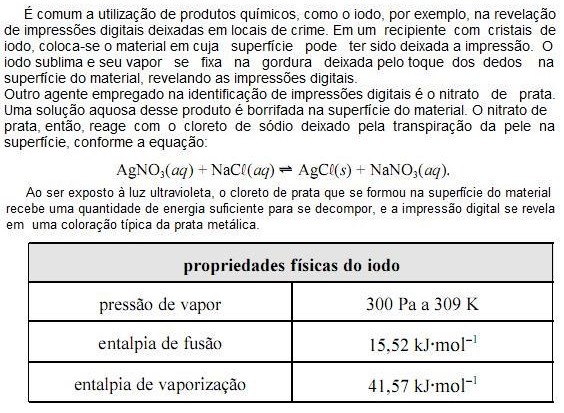
Na tabela a seguir são indicadas a massa e a composição dos gases contidos em quatro frascos.
Os frascos que contêm iguais quantidades em mol de átomos de oxigênio são:
A neutralização de 2,0 L de solução de ácido sulfúrico 0,25 mol/L foi feita cuidadosamente por um técnico de laboratório, utilizando hidróxido de sódio. A quantidade de NaOH utilizada pelo técnico, em gramas, foi:
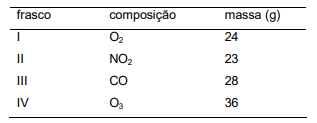
Considere os compostos orgânicos:
Apresentam caráter ácido e isomeria óptica, respectivamente, os compostos:
As representações químicas das substâncias: ácido fosfórico, dicromato de potássio, tiossulfato de bário, sulfito de alumínio e peróxido de sódio são, respectivamente:
Um químico reagiu um metal “B" com enxofre e obteve o sulfeto do referido metal. Assumindo que a massa utilizada do metal foi de 2,435 g (MMmetal = 121,75 g mol-1 ) e o que composto final apresentou massa igual a 3,397 g, qual a fórmula empírica do composto?
Os elementos Rb, I, Te e Sr pertencem ao 5º período da tabela periódica. Com relação a estes elementos químicos, assinale a alternativa correta.
A escolha dos materiais de laboratório empregados nas medidas das amostras nas análises químicas quantitativas é bastante relevante. Essas medidas devem ser feitas em instrumentos de precisão, tais como:
O rótulo de um frasco de efluente aquoso indica 100 ppm de íons chumbo(II). Sabendo-se que a densidade do efluente é 1,0 g/mL, a concentração de íons chumbo(II) no efluente, em mol/L, é igual a:
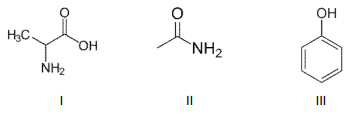
A aspirina® é um dos medicamentos mais comercializados nas farmácias. A estrutura química desse medicamento é apresentada na figura.
As funções orgânicas presentes na estrutura da aspirina são:
Com base nas informações do texto e da tabela apresentada acima e considerando que a constante universal dos gases ideais (R) seja igual a 8,0 JK1 mol1 e que o vapor de iodo obedeça à lei dos gases ideais, julgue os próximos itens.
A partir das informações do texto, é correto concluir que a reação AgCL(s) ? Ag(s) + ½ CL2(g) é catalisada por luz ultravioleta.
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Sabendo-se que o sódio e o cloro estão no mesmo período da Tabela Periódica e que o sódio pertence ao grupo 1 e o cloro, ao grupo 17, é correto concluir que a energia de ionização do cloro é superior à do sódio.