As massas aproximadas de água em gramas, adicionada a
uma amostra de 30 g de sacarose (C12H22O11) para que se
obtenha uma solução 10% em massa e de fração em mol
0,05 são, respectivamente,
Dados: C = 12; H = 1; O = 16
Qual é o sinal da variação de entropia para cada um dos
seguintes processos?
1- Um soluto cristaliza a partir de uma solução.
2- Água evapora.
3- AgCl sólido precipita a partir de uma solução de AgNO3 e
NaCl.
Para estes 3 casos podemos afirmar:
Representando metro por m, quilograma por kg e segundo por s, a potência por unidade de volume é expressa, no sistema internacional de unidades (SI), em
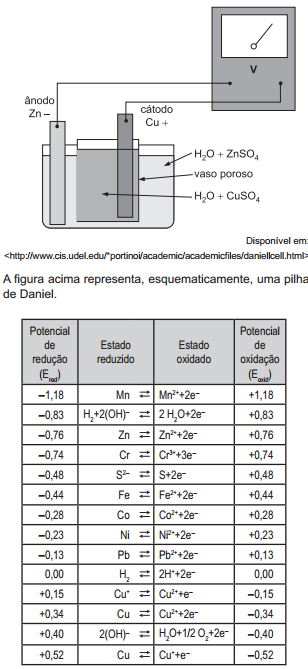
Uma solução de HlC. 0,0005M foi analiticamente padronizada, titulando-se um volume de 50 mL dessa solução com uma solução 0,001M de NaOH, sendo acompanhado
o parâmetro pH durante a adição da solução de NaOH. A curva titulométrica resultante é apresentada no gráfico.
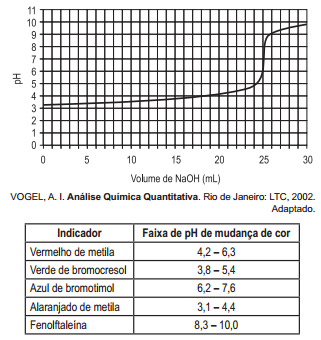
Considerando-se os indicadores ácido-base listados após
o gráfico, qual o indicador apropriado para a realização dessa análise?
Segundo definição da IUPAC, os nomes oficiais dos compostos obtidos quando um átomo de hidrogênio do metanal for substituído por um grupo (–OH) e por um grupo (–OCH3), respectivamente, são
Cada onda eletromagnética possui frequência própria. Estão em ordem crescente de frequência:
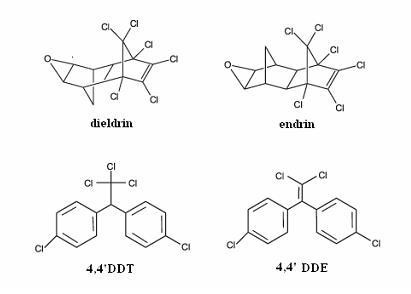
Considerando a figura acima, que ilustra as estruturas químicas de quatro pesticidas, julgue os itens que se seguem.
O dieldrin e o endrin são isômeros constitucionais.
A extração com solvente apolar ou de baixa polaridade consiste em uma técnica eficiente para a extração de compostos orgânicos a partir de soluções aquosas. Define-se o coeficiente de partição (K) como a razão entre as concentrações do composto no solvente orgânico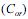 e na fase aquosa
e na fase aquosa 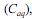 , quando atingido o
, quando atingido o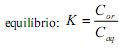
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
Considerando-se que o composto não sofra qualquer reação adicional nas fases aquosa e orgânica, é correto inferir que a porcentagem desse composto extraída pelo estudante A será maior que 80%.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam 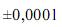 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 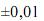 mL, para uma leitura de menisco no balão, julgue os próximos itens.
mL, para uma leitura de menisco no balão, julgue os próximos itens.
Entre os indicadores apresentados na tabela 1, o mais adequado à titulação em questão é o vermelho de metila.

Com base nessas informações, julgue os itens que se seguem.
Os complexos de metais de transição com configuração eletrônica d9 , tais como o complexo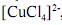 , caracterizam-se pela geometria quadrado planar.
, caracterizam-se pela geometria quadrado planar.
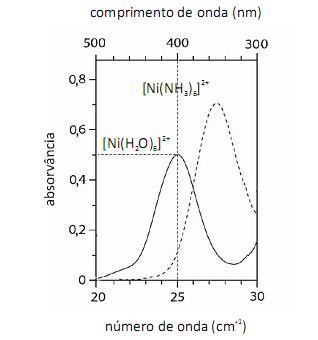

Considerando-se a teoria do campo cristalino e os espectros acima apresentados, é correto afirmar que a água consiste em um ligante de campo mais fraco que a amônia.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Considerando-se que o complexo 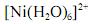 possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller.
possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller.

Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A reação acima é elementar, ou seja, processa-se em uma única etapa.

Considerando as informações acima e que todos os gases envolvidos sejam ideais, julgue os itens a seguir.
A capacidade calorífica molar, a volume constante, do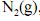
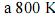 , é maior que
, é maior que 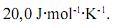 .
.

