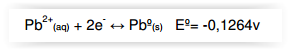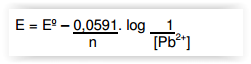Um litro de solução de ácido perclórico, HClO4, de pH = 2,0, foi diluído com água até o dobro do volume inicial. O pH da nova
solução
Dados: log 5 = 0,7
log 2 = 0,3
A seguir estão representadas as estruturas de alguns compostos orgânicos:
A maior solubilidade em água é observada para o
Atenção: A tabela a seguir se refere às questões de números 49 a 51.
São formados por substâncias classificadas como orgânicas somente os seguintes componentes presentes nesse leite:
Considere a semi-reação abaixo no estado
padrão:
Após um procedimento químico a concentração
dos íons Pb2+
(aq) nesse equilíbrio era de 10-6 mol/L.
O potencial de redução da semi-reação acima
após o procedimento químico a 25ºC é de: Equação de Nerst a 25ºC:
Um determinado volume (V ) de um ácido forte monoprótico com pH = 2 foi diluido com água destilada até um volume de 20V. O valor do pH da solução diluída a 25ºC é de: Dado: log 5 = 0,7.
Assinale a alternativa que contém a solução aquosa com menor temperatura de congelação.
Inicialmente, certa massa de gás se encontra a 1 atm e 200 K. Em seguida, ela é aquecida a 400 K a volume constante. Assinale a alternativa que corretamente expressa a pressão final dessa massa de gás (em atm), considerando comportamento de gás ideal e sistema isolado.
Em meio aquoso, considere um ácido com constante de dissociação (Ka) igual a 1,11x10–6
e água em
uma concentração de 55,5 mol L –1
. Assinale a alternativa que apresenta o valor correto para a constante
de equilíbrio (Keq).
Para a reação química A + B → P, tem-se:
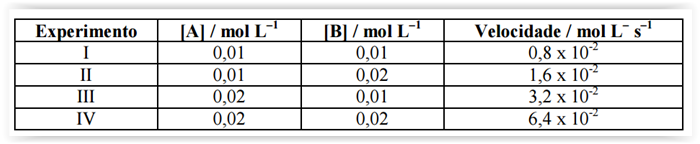
Assinale a alternativa que corretamente expressa a lei de velocidade para esta reação.
O petróleo bruto passa por diversos processos, quando chega às refinarias, que o transformam em várias substâncias, como diesel, gasolina, asfalto, entre outras. Dentre as opções abaixo, qual apresenta o nome do processo utilizado nessas refinarias que separa os seus hidrocarbonetos?
O cobre é um metal avermelhado encontrado na natureza, principalmente na forma de calcopirita, CuFeS2. No estado fundamental, qual é a configuração eletrônica correta do cobre (número atômico 29)?
O Cloreto de cálcio é um composto químico extremamente solúvel em água e é deliquescente. É um sal que se apresenta no estado sólido à temperatura ambiente e tem muitas aplicações comuns como em salmoura para máquinas de refrigeração, controle de pó e gelo nas estradas, e no cimento. Por causa de sua forte higroscopia, pode ser usado para secar o ar, assim como outros gases e líquidos orgânicos. A quantidade em mol de cálcio necessária para reagir com 2,5 mol de Cl –, para produzir o cloreto de cálcio, é
Dada a equação termoquímica,
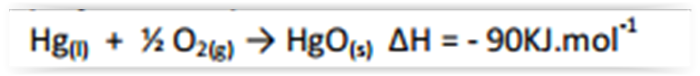
Dados: Hg = 200; O = 16
na formação de 72g de HgO(s), ocorre
A capacidade de uma reação espontânea, a T e P
constantes, para produzir trabalho útil é a energia livre de
Gibbs (∆G). Dependendo do sinal da variação de energia
livre, podemos verificar sua espontaneidade. Dadas as
seguintes afirmativas,
I. Se ∆G for negativo a reação a T e P constantes é
espontânea.
II. Se ∆G for positivo a reação a T e P constantes é não
espontânea.
III. Se ∆G for igual a zero o sistema está em equilíbrio.
IV. Se ∆G for positivo a reação a T e P constantes não se
deslocará em nenhuma direção.
verifica-se que estão corretas
Nas estações de tratamento de água para fins domiciliar,
pequenas quantidades de flúor são utilizadas para diminuir a
incidência de cáries dentárias. A fluoração é feita, utilizando
um sal que contém aproximadamente 0,95 ppm de íons F -. A
concentração em mol.L-1 de íons F- é
Dado: F = 19