Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue os itens subsequentes.
A condutividade elétrica é uma propriedade que depende da presença de íons dissolvidos em soluções iônicas, como ácidos, bases e sais, pois os íons permitem a passagem da corrente elétrica. A medida da condutividade é afetada pela temperatura, geralmente decrescendo com o aumento da temperatura.
Sobre as reações ácido-base é correto afirmar que são
O sulfato de alumínio (Al2(SO4)3) é um sal inorgânico muito utilizado em tratamentos de efluentes. Em pH adequado, o Al2(SO4)3 libera íons Al3+ que agem como floculantes em efluentes brutos. Qual a equação que melhor representa a ionização do Al2(SO4)3 ?
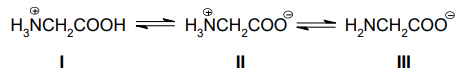
Devido à presença de dois grupamentos funcionais distintos, aminoácidos possuem caráter anfótero. Na sua forma cristalina, a carboxila protona o grupo amino, formando um íon duplo (zwitteríon). Contudo, quando em solução aquosa, a estrutura do aminoácido dependerá do pH do meio. A figura abaixo ilustra as três estruturas possíveis (I, II e III), que a glicina pode apresentar quando em solução.
A partir da análise da figura é correto afirmar que a glicina assumirá estrutura predominantemente
Julgue o item a seguir, relativo a ácidos e bases.
Pela definição de Brønsted‐Lowry, um ácido é uma substância doadora de prótons em água e uma base é uma substância receptora de prótons em água. Pela definição de Lewis, um ácido é uma substância que pode doar um par de elétrons para formar uma ligação. Uma base de Lewis é definida como uma substância que pode aceitar um par de elétrons para a formação de uma ligação covalente.
Considere a reação química a seguir
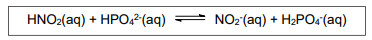
De acordo com a teoria ácido-base de Bronsted-Lowry, nessa reação o
Em certas regiões, a água é rica em íons Ca2+ e/ou Mg2+. Esse tipo de água é chamado de água dura. Nela, os sabões não atuam de modo satisfatório, o que pode diminuir ou até mesmo anular completamente a eficiência da limpeza. Para resolver esse problema, os fabricantes de sabões adicionam ao produto o composto tripolifosfato de sódio, Na5 P3 O10, cuja função é se ligar aos íons Ca2+ e Mg2+. No entanto, como os sabões usados nas residências atingem o sistema de esgotos, o tripolifosfato acaba indo para rios e lagos, o que se torna prejudicial ao ambiente.
VILELLA, G. Reação de saponificação. Disponível em: http://quimicasemsegredos.com. Acesso em: 7 jul. 2015 (adaptado).
Os sabões que contêm esse composto, ao serem lançados nos rios e lagos, causam danos ao ambiente, pois eles
Julgue o item a seguir, relativo a ácidos e bases.
Um exemplo simples de uma reação ácido‐base é a reação de um próton com o íon hidróxido. Nessa reação, o íon hidróxido é um ácido de Lewis porque recebe o par de elétrons que se torna compartilhado com o hidrogênio.
Sobre a reação a seguir é CORRETO afirmar:
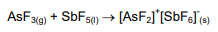
Utilizando a regra química de número de átomos de oxigênio menos o número de átomos de hidrogênio ionizáveis, assinale a alternativa que contém um ácido considerado forte:
Assinalar a alternativa CORRETA:
Considere as reações abaixo, as afirmativas a seguir e assinale a alternativa correta:

I. Segundo a teoria de Brønsted-Lowry, o íon bicarbonato na Reação 1 é um ácido.
II. Segundo a teoria de Lewis, a amônia na Reação 2 é uma base, pois ela doa elétrons.
III. Segundo a teoria de Lewis, o íon bicarbonato na Reação 1 é anfótero.
IV. Segundo Brønsted-Lowry, o íon carbonato na Reação 1 é uma base, chamada de base conjugada do íon bicarbonato.
V. Todas as bases de Brønsted-Lowry mostradas nas equações são também consideradas bases de Lewis.
Assinale a alternativa correta:
Com relação as teorias ácido-base, avalie o acerto das afirmações adiante e marque com V as verdadeiras e com F as falsas.
( ) A amônia pode ser considerada uma base de Arrhenius, pois se associa a um próton para formar o cátion amônio.
( ) Mg 2+ tende a se ligar mais facilmente com o ligante SCN-do que com o ligante Cl-, pois segundo a classificação de Pearson, ácidos duros tendem a se ligar com bases duras.
( ) Dióxido de carbono na presença de íons OH-, atua como um ácido de Lewis, gerando íons bicarbonato como produto.
( ) O íon bicarbonato é mais básico que o íon carbonato.
( ) Ácido acético e íon acetato podem ser considerados respectivamente ácido e base conjugada, pela teoria ácido-base de Brõnsted-Lowry.
Marque a opção que contenha a sequência CORRETA, de cima para baixo:
Sobre os ácidos inorgânicos, assinale a afirmativa INCORRETA.
Para facilitar o trabalho dos químicos, os compostos químicos foram dividos em diversas classes ou funções. Duas funções importantíssimas são os ácidos e as bases. Historicamente, os conceitos que definem os ácidos e as bases mudaram conforme a evolução dos conceitos e o entendimento da química. Diante do exposto, analise as afirmativas.
I. O sueco Svante Arrhenius recebeu o Prêmio Nobel de Química devido aos seus trabalhos de dissociação eletrolítica. Dentro destas teorias, tem‐se as seguintes definições: “ácido é toda substância química que, em água, libera como cátion exclusivamente íons H+” e “base é toda substância química que, em água, libera como ânions exclusivamente íons H+”. Trata‐se da teoria iônica.
II. Em 1923, Johannes Nicolaus Bronsted e Thomas Martin Lowry propuseram, independente, a teoria ácido‐base de Bronsted‐Lowry. Para eles, “ácido é toda substância que libera íons H+” e “base é toda substância que recebe (ou aceita) íons H+”. Trata‐se da teoria protônica.
III. Gilbert Newton Lewis, em 1916, foi um dos grandes responsáveis pelas explicações adequadas sobre as ligações covalentes, a partir do estudo do comportamento dos elétrons. Para Lewis, “ácido é toda substância capaz de aceitar (ou receber pares de elétrons) pares de elétrons de outra substância” e “base é toda substância capaz de doar (ou ceder pares de elétrons) pares de elétrons para outra substância”. Trata‐se da teoria eletrônica.
Está(ão) correta(s) a(s) afirmativa(s)