Qual a diferença entre o tempo de meia vida de uma reação de primeira ordem e de segunda ordem?
De acordo com a equação química abaixo, considerando-se a constante dos gases como 0,082, o valor de Kp (constante de equilíbrio em termos de pressão parcial), quando Kc (constante de equilíbrio em termos de concentração) é igual a 8,5 à 300º C, será

O tamanho do íon depende de sua carga nuclear, número de elétrons e dos orbitais com elétrons de valência. De acordo com a afirmativa descrita, é correto afirmar que
Em uma pilha combustível ocorre as seguintes semi - reações representadas abaixo, responda à questão
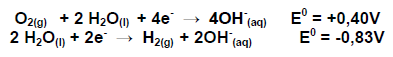
A reação global da pilha no estado padrão e seu valor do potencial padrão da pilha são, respectivamente,
A fórmula estrutural de um dos constituintes do jambu, erva típica da região Norte e muito apreciada na culinária paraense, é a seguinte:
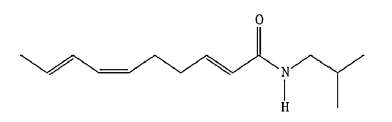
Sobre esta substância, faz-se as seguintes afirmativas:
I- possui a função amina,
II- apresenta 7 carbonos com hibridação sp²,
III- possui 23 átomos de hidrogênio,
IV- pode apresentar isomeria óptica,
V- apresenta a função amida.
Estão corretos os itens
Julgue as afirmativas a seguir, sobre o HCN.
I- Devido à eletronegatividade de seus elementos, possui geometria angular.
II- Sua base conjugada é o íon carboneto.
III- Trata-se de um composto covalente.
IV- Seu átomo de carbono tem hibridação sp3.
V- Possui ligação carbono-nitrogênio mais curta que aquela presente na metilamina.
Está correto o que se afirma em
Ao adoçar 700 mL de suco de cupuaçu em uma jarra a 35 °C, uma pessoa utiliza 0,8 mols de glicose (C6H12O6), obtendo uma solução saturada sem corpo de fundo. Contudo, depois de ter colocado esta jarra em um refrigerador por duas horas, nota-se o acúmulo de uma certa quantidade de açúcar no fundo da jarra. Considerando que o coeficiente de solubilidade do açúcar no suco de cupuaçu é de 0,15 g/mL, e que as massas atômicas são C=12, H= 1 e O= 16, o número aproximado de mols de glicose não-dissolvidos a 0 °C é de
Considere as substâncias a seguir para responder a questão.
I- Fenilamina
II- Fenol
III- Benzeno
IV- Acetofenona (fenil-metil cetona)
V- para-metilbenzoico
VI- ciclohexamina
VII- para-clorobenzoico
VIII- orto, para-diclorobenzoico
IX- benzoico
A ordem crescente de polaridade dos compostos de I a V é
Assinale a opção correta no que diz respeito a transformações, reações e substâncias químicas.
O dióxido de enxofre (S02) e o dióxido de nitrogênio (N02), liberados, por exemplo, pela atividade industrial, podem reagir com o vapor d'água da atmosfera e originar o ácido sulfúrico (H2S04) e o ácido nítrico (HN03), respectivamente, sendo responsáveis diretamente pela(o):
Para a separação dos diferentes derivados do petróleo, as indústrias petroquímicas utilizam a:
O grau de insaturação de um ácido graxo é indicado pela( o):
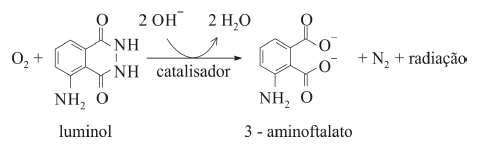
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
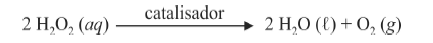
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Na molécula do luminol, os hidrogênios do grupo NH2 ligado ao anel aromático são mais ácidos do que os hidrogênios dos grupos NH presentes no segundo ciclo.
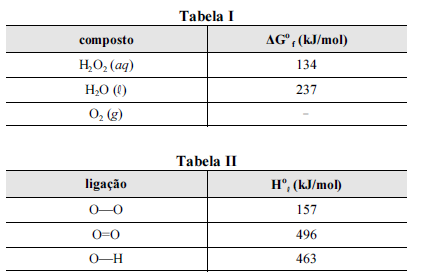
A seguir são apresentadas informações referentes à reação de decomposição do H 2O2.
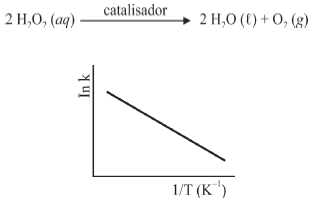
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é y = 30 - 3,0 × 10 4 x.
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGº f) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (Hº l), respectivamente.
Considerando que a reação de decomposição do H 2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue os itens subsequentes, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de equilíbrio da reação de decomposição do H2O2 é superior ao verificado em temperaturas mais baixas.
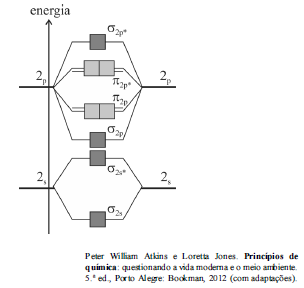
A figura anterior mostra o esquema de orbitais moleculares resultantes da combinação dos orbitais 2s e 2p dos átomos de oxigênio na molécula de O 2.
Com base no diagrama apresentado e na teoria dos orbitais moleculares (TOM), julgue o item subsecutivo.
De acordo com a TOM, o íon molecular O2 + possui ordem de ligação maior do que a molécula neutra de O2.