Considere que, para determinar a concentração de uma solução de H
2S, um químico tenha misturado uma alíquota de 20,0 mL dessa solução com 20,0 mL de uma solução-padrão de NaOH (aq) 0,430 mol/L. Após a reação de neutralização, ele determinou o excesso de NaOH na solução resultante por meio da titulação dessa solução com 20,0 mL de uma solução-padrão de HC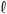
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita, tiverem sido gastos 16,0 mL da solução que contenha o excesso de NaOH, então infere-se que a concentração da solução de H2S é igual a 9,00 × 10-2 mol/L.
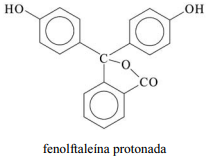
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
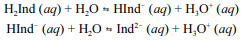
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A fórmula molecular da fenolftaleína protonada é C20H16O4.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
De acordo com a tabela periódica atual, os elementos de um mesmo período, por apresentarem o mesmo número de elétrons de valência, formam compostos químicos com características semelhantes.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O produto principal da reação de hidratação do propeno em meio ácido é o 1-propanol.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
De acordo com a teoria das colisões, um aumento na temperatura de reação ocasiona aumento no número total de colisões entre as espécies reagentes e na fração de colisões efetivas.
Correlacione as ilustrações de vidrarias básicas comumente usadas em laboratórios de química com as informações a seguir.
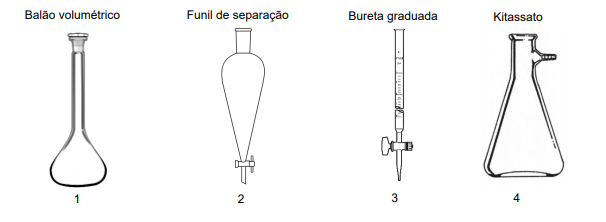
( ) Vidraria usada junto com o funil de Büchner em filtrações a vácuo.
( ) Vidraria de elevada precisão e exatidão analítica usada no preparo de soluções.
( ) Vidraria usada para separar líquidos imiscíveis de diferentes densidades.
( ) Vidraria usada na titulação de soluções.
A sequência correta, de cima para baixo, é:
A extração líquido-líquido baseia-se na diferença de solubilidade de um soluto em dois líquidos imiscíveis. Portanto, a quantidade do soluto que é extraída depende do seu coeficiente de partição ou coeficiente de distribuição (K) entre as duas fases líquidas. Qual a porcentagem aproximada de um soluto extraído para 100 mL de éter de petróleo, supondo que foram usados 100 mL de fase aquosa contendo 5 g do soluto, após agitação em funil de separação?

Através de análise gravimétrica, o Ca++ em águas naturais pode ser determinado após adição de H2C2O4 e alcalinização com NH3, o que leva à formação do precipitado CaC2O4, que, após aquecimento a 1200°C, é convertido a CaO. Acerca disso, analise as proposições abaixo.
1) O produto da reação do Ca++ com H2C2O4 é um sal insolúvel que pode ser corretamente chamado de oxalato de cálcio.
2) O composto H2C2O4, adicionado na metodologia descrita, pode ser considerado um oxiácido forte, chamado corretamente de ácido oxálico.
3) A partir das condições descritas na metodologia, a base forte Ca(OH)2, chamada corretamente de hidróxido de cálcio, pode ser obtida.
Está(ão) correta(s), apenas:
A respeito dos conhecimentos básicos necessários para a correta preparação e aplicação de soluções tampão, assinale V para as afirmações verdadeiras, ou F para as falsas.
( ) Solução tampão é uma mistura de um ácido fraco e sua base conjugada, ou uma base fraca e seu ácido conjugado.
( ) A diluição de uma solução tampão ou a adição de pequenas quantidades de ácidos ou bases provoca uma grande variação no pH final dessa solução.
( ) Para a manutenção do pH adequado em um experimento de digestão alcalina, a tripsina, que apresenta pH ótimo em torno de 8, deve ser incubada, preferencialmente, em solução tampão pH 6 ao invés de pH 9.
( ) Uma solução tampão pode ser preparada pela combinação de quantidades calculadas de um par ácido-base conjugado adequado.
A sequência correta, de cima para baixo, é:
O gás dióxido de enxofre (SO 2) é um dos principais e mais perigosos poluentes ambientais. No Brasil, é usado pelo Conselho Nacional de Meio Ambiente (Conama) como um importante indicador do padrão nacional de qualidade do ar (Resolução CONAMA nº 03, de 28/06/90). Para a adequada interpretação dos dados analíticos na determinação das concentrações de SO2 no ar atmosférico, frequentemente é necessária a conversão de quantidade de matéria presente no ar atmosférico em quantidade de mols. Assim, assinale a alternativa que indica, para uma amostra de ar atmosférico contendo 8g de SO2, aproximadamente, a quantidade de moléculas de SO2 presentes, assim como o número de mols de SO2, respectivamente.
(Dados: número de Avogadro=6,02x1023 ; massa atômica O=16, S=32)
Analise as reações químicas representadas a seguir acerca da aplicação do método de Mohr na determinação de Cl-1 em água do mar, em diferentes valores de pH. A respeito do balanceamento químico dessas reações, assinale a alternativa que apresenta a soma dos valores corretamente atribuídos a: x,y,k,z,w.
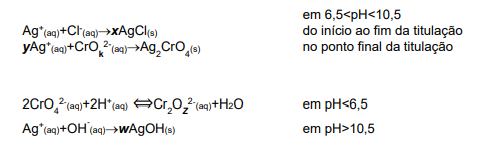
Com base nas estruturas químicas fornecidas a seguir (I a V), analise as proposições abaixo.
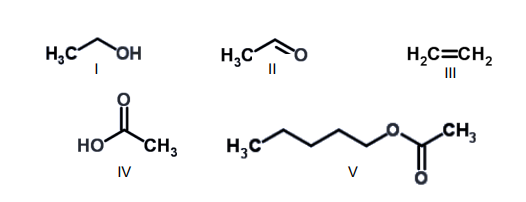
1) As estruturas I e II apresentam mesma forma molecular (C2H6O) e pertencem à mesma classe de substâncias orgânicas.
2) O composto orgânico III corresponde a um hidrocarboneto insaturado, e apresenta menos átomos de hidrogênio por carbono que o seu alcano correspondente.
3) O grupo funcional encontrado na molécula IV é chamado de carboxila, e corresponde à combinação de uma carbonila e uma hidroxila.
4) Na molécula V, o grupamento carbonila está presente, e caracteriza esse grupo de compostos orgânicos, denominados éteres.
Está(ão) correta(s), apenas:
Em um laboratório didático de Química, o técnico necessita preparar soluções para as aulas práticas solicitadas pelos docentes. Suponha-se que o professor da disciplina encaminhou pedido descrevendo a necessidade de soluções de hipoclorito de sódio, perclorato de amônio e dicromato de potássio. Quais substâncias o técnico usaria para atender ao pedido?
Neil Bartlet contribuiu, na década de 1960 com suas pesquisas, com a compreensão da reatividade dos gases nobres. Um exemplo de composto que contém um gás nobre é o pentafluorxenato de tetrametilamônio, de fórmula N(CH3)4XeF5. O íon XeF5- , presente na substância citada, apresenta geometria planar pentagonal. Sobre este íon, é correto dizer que o número de elétrons não ligados corresponde a:
Professor Dimitri desenvolveu uma aula de preparo de soluções com seus 30 alunos do curso técnico em agropecuária integrado ao ensino médio. Cada estudante preparou 100 mL de solução de hidróxido de sódio, de concentração 4 g/L. Ao finalizar a aula, o professor solicitou ao técnico que ele neutralizasse a totalidade de soluções preparadas e descartasse-as. Prontamente o laboratorista localizou uma solução de ácido clorídrico 6 mol/L e procedeu à neutralização. Qual o volume necessário para a neutralização ácido-base, admitindo que todos os estudantes tenham conseguido soluções com a concentração pedida?

