Qual é o pH de uma solução-tampão preparada pela adição de 0,060 mol de ácido lático e 0,050 mol de lactato de sódio em 500 mL de água?
(Informações adicionais: pH = pKa + log [A- ]/[HA]; - log Ka = 3,85; log 0,83 = -0,08; log 1,2 = +0,08; log 1 = 0)
- Quando dois ou mais compostos, orgânicos ou inorgânicos, têm a mesma composição, mas um arranjo atômico diferente, esses compostos são denominados isômeros. No que diz respeito à possibilidade de isomerismo em complexos octaédricos de cobalto, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
(en = etilenodiamina, H2N-CH2-CH2-NH2)
( ) [Co(en)3]3+ apresenta isomerismo ótico.
( ) trans-[Co(en)2Cl2]+ apresenta isomerismo ótico.
( ) [Co(NH3)4Cl2]+ apresenta isomerismo geométrico.
( ) [Co(NH3)5NO2]2+ apresenta isomerismo de ligação.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O sulfato é um dos íons mais abundantes na água marinha e estuarina, estando presente nas seguintes formas e proporções médias: SO42- (39%), Na2SO4 (37%), MgSO4 (19%) e CaSO4 (4%), a 250ºC e pH 8. Um método simples e acessível rotineiramente usado na determinação de sulfato em amostras de água baseia-se na adição de uma solução de cloreto de bário na amostra contendo o íon sulfato, conforme a seguinte reação:

Considere que a quantidade do reagente precipitante adicionado à amostra tem concentração estequiometricamente suficiente para reagir com a concentração de sulfato previamente estimada como normal para águas doces e marinhas, e que ocorre a formação de sulfato de bário em suspensão coloidal. Diante do exposto, assinale a alternativa que representa a técnica de análise que pode ser empregada para a determinação de sulfato, com base na medida da redução da transmissão de luz no meio causada pela formação de partículas.
O descarte de cosméticos e medicamentos diretamente na rede de esgoto é uma considerável via de contaminação das águas do mar. Observe a figura a seguir, que ilustra uma curva analítica típica, construída a partir da análise espectrofotométrica de concentrações conhecidas de um antibiótico macrolídeo, com os valores de absorbância plotados no eixo y e os valores de concentração no eixo x, expressos em g.L-1 . Supondo que o valor de z, marcado na figura, corresponde ao valor de absorbância de uma amostra de efluente coletada próximo a um hospital público e submetida a um processo de pré-tratamento para a concentração do composto de interesse e eliminação dos interferentes da amostra, assinale a alternativa que representa a concentração aproximada do antibiótico macrolídeo na amostra de efluente.

Em um laboratório de análises químicas são usados diariamente vários produtos químicos que representam fatores de risco à saúde e exigem do técnico de laboratório conhecimento acerca dos equipamento de proteção individual (EPIs) e coletiva (EPCs). A esse respeito, assinale a alternativa que contém os EPIs e EPCs mais adequados ao manuseio de solventes orgânicos voláteis e inflamáveis.
Nos laboratórios de química, o preparo de soluções é uma prática comum, que requer equipamentos e vidrarias básicas de laboratório. A respeito da utilização de diferentes vidrarias nesse processo, assinale a alternativa correta.
Para extrair substâncias químicas de polaridades distintas em uma amostra aquosa, uma estratégia possível é empregar um modelo de extração liquido-liquido-liquido com dois diferentes solventes extratores utilizados sucessivamente, com o auxílio de um funil de separação. Após a 1ª extração com um solvente extrator, denominado SOLVENTE 1, os dois líquidos imiscíveis foram recolhidos separadamente e denominados FRAÇÃO A (líquido localizado na porção inferior no funil de separação) e FRAÇÃO B (acima da FRAÇÃO A). Em seguida, a Fração B foi submetida a uma nova extração, com um novo solvente extrator, denominado SOLVENTE 2, e apenas o líquido localizado na porção inferior do funil de separação foi recolhido (denominado FRAÇÃO C). A esse respeito, considere as informações descritas na Tabela a seguir, com valores obtidos a 25ºC, e assinale a alternativa correta.

De acordo com a equação a seguir e as informações hipotéticas da tabela apresentada, a respeito da produção de gás metano (CH4) partindo de CS2 (g) e 4H2(g) à 500ºC, assinale a alternativa que apresenta o correto comportamento das mudanças qualitativas nas concentrações dos reagentes e produtos à medida que o sistema se aproxima do equilíbrio, se a temperatura foi mantida a 500ºC.
Considere Kc a constante de equilíbrio de concentração.

Em análises quantitativas, um padrão primário, preparado por pesagem direta de uma substância suficientemente pura e diluição até determinado volume de solução é frequentemente empregado como solução de referência. Nesse contexto, assinale a alternativa correta.
A vanilina é um composto cristalino de cor branca, solúvel em clorofórmio e éter, de fórmula molecular C8H8O3, amplamente utilizado como aromatizante, mas também como intermediário para síntese de herbicidas, agentes antiespumantes ou fármacos. Para essa molécula, podem ser atribuídas adequadamente as seguintes funções orgânicas:


Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Na alquimia, a transformação da matéria era discutida a partir de concepções filosóficas permeadas de misticismo.

Considere as reações I, II e III a seguir.
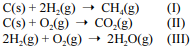
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023 moléculas de H2(g) para a formação de 32,0 g de metano.

Considere as reações I, II e III a seguir.
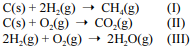
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação I, e que m2 gramas de O2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação II. Conforme a lei de Richter, são necessários 2 × m1 gramas de H2(g) para reagir completamente com m2 gramas de O2(g), de acordo com a reação III.
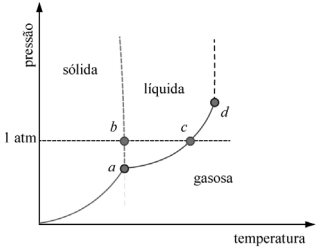
A figura precedente mostra um diagrama de fase para uma substância pura que exibe três fases: sólida, líquida e gasosa. Com base nessas informações, julgue o item subsecutivo.
No ponto a da figura do diagrama de fase, as fases gasosa, líquida e sólida coexistem.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A massa de H2S presente em 250 mL de uma solução aquosa com concentração 0,100 mol/L do ácido é superior a 1,0 g.

