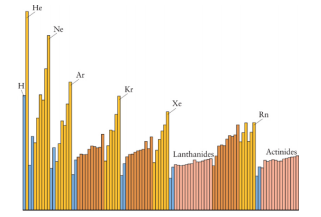
Considere a figura abaixo que apresenta a variação de uma propriedade periódica em função do número atômico.
De acordo com a tendência geral das propriedades periódicas, a propriedade apresentada na figura acima poderia ser
Bases de Schiff, ou iminas, são compostos obtidos através da reação de desidratação entre moléculas que contenham o grupo carbonila, como aldeídos ou cetonas, e moléculas que contenham a função amina. Um esquema da formação de uma base de Schiff é
Considerando que as diferentes substâncias são formadas por diferentes formas de combinação de átomos dos elementos químicos, assinale a opção correta.
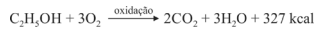
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de 109 kcal.
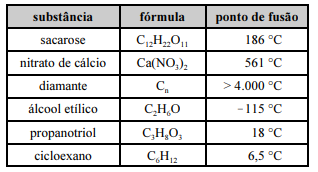
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
O nitrato de cálcio é um exemplo de sólido iônico, formado por íons, mas que apresenta ligações covalentes na sua estrutura.

Considere as reações I, II e III a seguir.
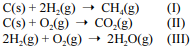
Com relação a essas informações, julgue o item que se segue.
De acordo com as leis das reações gasosas de Gay Lussac, sob mesma temperatura e pressão, o volume ocupado pelo CO2 é maior que o volume do O2 na reação II.
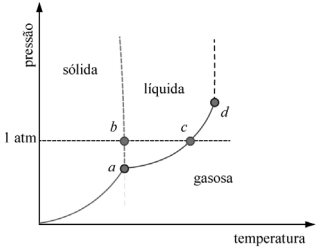
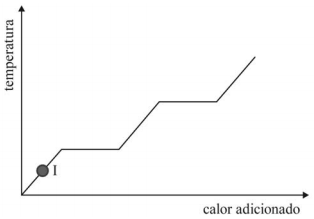
A figura precedente mostra um diagrama de fase para uma substância pura que exibe três fases: sólida, líquida e gasosa. Com base nessas informações, julgue o item subsecutivo.
O ponto b indicado na figura precedente está corretamente localizado e representado pelo ponto I na curva de aquecimento seguinte.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A concentração de íons S2- em uma solução aquosa de H2S 0,100 mol/L é inferior a 1,0 × 10-10.
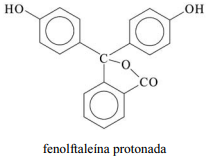
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
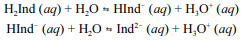
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A molécula de fenolftaleína protonada apresenta as funções fenol e éster.

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
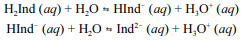
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
Considerando que a fenolftaleína seja incolor em pH reduzido e rosa em pH elevado, infere-se que a forma protonada da fenolftaleína é a que apresenta coloração rosa.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A razão de os elementos químicos emitirem um espectro descontínuo de energia (espectros de linhas) é que, conforme proposto por Rutherford, os prótons ocupam uma região central muito pequena, denominada núcleo, ao passo que os elétrons se localizam em uma região extranuclear de dimensões muito maiores.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O propeno é muito mais reativo do que o eteno no que diz respeito à reação de hidratação catalisada por ácido.
Nos dias atuais, várias instrumentações analíticas permitem detecção e/ou quantificação de diferentes sustâncias químicas, mesmo em pequenas concentrações. Portanto, a adequada eliminação dos resíduos nos materiais, equipamentos e instrumentos de laboratório é uma etapa crucial para a análise. A esse respeito, assinale a alternativa correta.
A oxidação do ferro para a formação de ferrugem envolve várias etapas, mas pode ser descrita, de maneira simplificada, da seguinte forma:
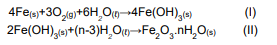
A esse respeito, assinale a alternativa correta.
Questão anterior:

De acordo com a metodologia descrita anteriormente para a determinação gravimétrica do cálcio (questão 37), a partir de 150 mL de uma amostra de água natural foram determinados 0,2941 g de CaO (56,077 g.moL-1). Qual a concentração de Ca (40,078 g.moL-1) na amostra de água, expressa em unidades de gramas por 100 mL de água?