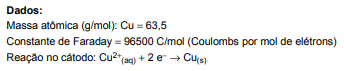Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
As reações de oxidação e redução envolvem a transferência de elétrons de uma espécie molecular ou iônica para outra. A redução é a perda de elétrons por uma dada espécie e a oxidação é a fixação desses elétrons por uma determinada espécie.
Quanto a compostos orgânicos e a reações de caracterização, julgue o item a seguir.
A identificação de compostos insaturados é possível por meio das reações de adição. No método com adição de bromo em tetracloreto de carbono, o teste será positivo se a solução se descolorar imediatamente, com formação de precipitado marrom. No teste com permanganato, será positivo se ocorrer a descoloração da solução, que é avermelhada. Ambos os testes confirmam a presença de insaturação.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item a seguir.
A troca iônica é um processo no qual os íons presos em uma resina trocadora de íons (um sólido poroso insolúvel) são trocados por íons presentes em uma solução que é levada ao contato com o sólido. Resinas trocadoras de íons têm aplicação no processo de desionização de água, na purificação de soluções e na separação de íons.
A Lei n.o 2.800/1956 cria os Conselhos Federal e Regionais de Química, dispõe sobre a profissão do químico e dá outras providências. De acordo com os ditames da Lei n.o 2.800/1956, julgue o item a seguir.
Entre as atribuições do Conselho Federal de Química, incluem‐se as de convocar e realizar, periodicamente, congressos de conselheiros federais e regionais para estudar, debater e orientar assuntos referentes à profissão.
A Lei n.o 2.800/1956 cria os Conselhos Federal e Regionais de Química, dispõe sobre a profissão do químico e dá outras providências. De acordo com os ditames da Lei n.o 2.800/1956, julgue o item a seguir.
Os Conselhos Regionais de Química devem fiscalizar o exercício da profissão de químico, cabendo somente ao Conselho Federal de Química a aplicação de penalidades decorrentes da infração à lei.
A glicose e a frutose são oses que possuem a mesma fórmula molecular: C6H1206. A diferença entre essas duas oses é que os grupos funcionais são diferentes, conforme mostrado em suas fórmulas estruturais.
A partir das fórmulas estruturais dessas oses é possível concluir que são isômeros de função, pois a glicose é uma:
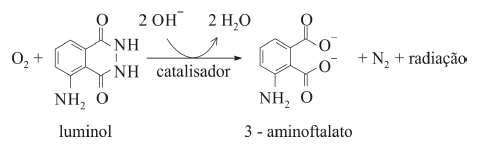
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
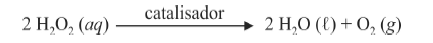
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2 decompostas é maior na reação realizada em presença do catalisador do que na reação não catalisada.
Sobre as leis da química, analise as sentenças a seguir:
I - A lei de Lavoisier defende que numa reação química, que se processe em um sistema fechado, a massa permanece constante, isto é, a soma das massas dos reagentes é igual à soma das massas dos produtos;
II - De acordo com Proust (Lei de Proust), numa reação química, a proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável;
III - “Na natureza nada se cria, nada de perde, tudo se transforma" faz referência a Lei de Proust.
Sobre as sentenças anteriores, pode afirmar que:
Uma amostra de carbonato de sódio (Na
2CO3) impuro de 5,00 g foi totalmente dissolvida em 500 mL de ácido clorídrico (HC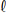
A ocorrência de um fenômeno químico é a
A espectrofotometria na região do ultravioleta e do visível (UV-vis) é um método analítico amplamente utilizado nos laboratórios de controle da qualidade das águas para análise de ferro. Sobre os princípios da técnica, é correto afirmar que
A determinação dos sólidos que constituem todas as substâncias que permanecem na cápsula após a total secagem de um determinado volume de amostra de água, em estufa (105 ± 2 °C) até peso constante, refere-se aos sólidos
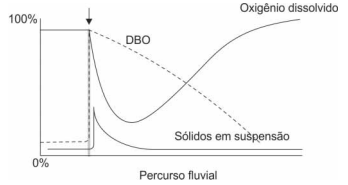
Considere a ilustração abaixo.
O evento indicado pela seta representa:
A determinação do OD (oxigênio dissolvido) na água pode ser feita por meio do método Winkler. Nesse método, o OD é fixado através da adição de sulfato de manganês(II), em meio alcalino. Em seguida adicionam-se íons iodeto e o meio é acidificado, ocorrendo liberação de iodo que é titulado com solução de tiossulfato de sódio. Em uma análise de controle, foram coletados 200 mL de água e, após o tratamento preliminar, de acordo com o método Winkler, titulou-se a amostra com solução de Na 2S2O3 0,01 mol/L, consumindo-se 8,0 mL desse reagente. A concentração do oxigênio dissolvido, em mg/L, nessa amostra é
Dados:
1 mol de O2 equivale a 4 mols de Na2S2O3 no método Winkler
Massas molares (g/mol):
Na = 23
S = 32
O = 16
A massa de cobre metálico, em gramas, que será depositada no cátodo de uma célula eletrolítica contendo solução de CuSO 4, submetida a uma corrente de 2,0 Amperes, durante 10 minutos, considerando rendimento eletrolítico de 100%, é igual a