O ar atmosférico é formado por vários componentes, incluindo vários gases, vapor d'água, micro-organismos e impurezas. O gás mais abundante presente no ar atmosférico é:
O átomo de magnésio (Mg) possui massa atômica de 24 u.a (unidades atômicas) e número de prótons igual a 12. Calcule o número de nêutrons e número de elétrons contidos no átomo de Mg, calcule o número de prótons e o número de elétrons do cátions formado pelo Mg. A seguir assinale a alternativa que contenha respectivamente os números apresentados.
A fermentação da glicose (C 6H12O6) produz etanol (C2H6O) e dióxido de carbono (CO2), conforme a equação química não balanceada abaixo:

(Massas molares (g mol
-1): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
Soluções aquosas que contêm um par ácido-base conjugado fraco podem resistir drasticamente às variações de pH com a adição de pequenas quantidades de ácido ou base forte. Elas são chamadas de soluções-tampão (ou simplesmente tampão). Nesse sentido, qual é a quantidade de matéria, em mol, de NH 4Cl que deve ser adicionada a 2,0 L de 0,10 mol L-1 de NH3 para formar um tampão cujo pH é 9,00? Suponha que a adição de NH4Cl não altere o volume da solução.
(Dados: Kb = 1,8 x 10-5 ; pOH = 14,00 – pH)
Em dias muito frios, é comum que encanamentos de água se rompam devido ao processo de congelamento. Esse fenômeno é atribuído ao fato de a água se expandir ao congelar. Quanto trabalho, em joules, uma amostra de 100 g de água realiza ao congelar em 0 ºC e estourar um cano de água que exerce uma pressão oposta de 1,070 atm?
(As densidades da água e do gelo, em 0 °C, são 1,00 e 0,92 g cm-3, respectivamente. w = - Pext ∆V; 1 L atm = 101,325 J)
A diferença de potencial entre dois eletrodos em uma célula voltaica fornece a força eletromotriz que empurra os elétrons por um circuito externo. Para uma pilha, essa força é denominada potencial da célula (E). Sob condições-padrão (concentração das soluções de 1 mol L-1, pressão 1 atm e 25 ºC), tem-se o potencial-padrão da célula (Eºcélula), que pode ser determinado pela diferença dos potenciais-padrão de redução das reações que acontecem no catodo (Eºcatodo) e anodo (Eºanodo). Sabendo que os Eº das células voltaicas Zn-Cu2+, Ni-Cu2+ e Zn-Fe2+ são +1,10, +0,62 e +0,32 V, respectivamente, assinale a alternativa que apresenta o Eº da célula voltaica Fe-Ni2+.
São características físicas e organolépticas das águas de abastecimento público, EXCETO:
A titrimetria está didaticamente dividida em quatro ramos, classificados de acordo com a reação química principal envolvida na determinação. Marque a 2ª coluna em relação a 1ª e assinale a alternativa correspondente.
I. Titrimetria ácido-base.
II. Titrimetria de Óxido-Redução.
III. Titrimetria de Precipitação.
IV. Titrimetria de Complexação.
( ) O pH (potencial hidrogênio (H)) representa a quantidade de íons hidrogênio (H+) presentes em uma solução. É um importante condicionador de reações químicas, sendo de extrema importância sua precisa determinação e controle.
( ) Esse método envolve o uso de agentes oxidantes para a titulação de agentes redutores (e vice-versa). Tendo como restrição básica a necessidade de grande diferença entre os potenciais de oxidação e redução, de modo a ter -se mais nítidos resultados, sendo estes detectados por meio de indicadores químicos ou de vários métodos eletrométricos (indicadores físicos).
( ) O agente titulante forma um produto insolúvel com o analito. Apesar de ser efetuada com técnicas semelhantes às da Gravimetria, não está limitada pela necessidade de uma massa final mensurável, podendo lançar mão de outros parâmetros para a quantificação de resultados.
( ) Objetiva a formação de um complexo (solúvel em água) com o analito, um íon metálico, este reagente muitas vezes é um agente quelante. As reações envolvidas podem ser controladas pelo pH.
A geração indiscriminada de Resíduos Sólidos (RS) causam riscos ao equilíbrio ambiental e à saúde pública ao passo que é considerada como um dos problemas ambientais mais preponderantes na atualidade. Sobre os impactos causados por resíduos sólidos, é INCORRETO afirmar que:
Com relação à segurança em laboratório, marque V(verdadeiro) ou F (falso) e assinale a alternativa correspondente. ) Ao montar aparelhos de vidro ou inserir tubos em rolhas, deve-se usar os devidos equipamentos de proteção, tais como luvas, óculos, além de envolver o tubo num tecido para maior proteção. ) É recomendável aquecer líquidos em chapas de aquecimento elétrico ou em banho-maria. ) Para aquecer líquidos em bico de Bunsen e recipiente de vidro, sempre que possível usar placa de vitrocerâmica. ) Para operações frequentes com frascos grandes, isto é, acima de 3 litros, usar um revestimento de borracha de neoprene sobre a bancada.
Assinale a alternativa que completa correta e respectivamente as lacunas. Um dos problemas ambientais ocorridos nas grandes cidades é o lançamento de CO2 pela queima de combustíveis fósseis nos automóveis. O correto balanceamento para a reação da queima da gasolina, segundo a reação____C8H18+___ O2 → CO2___ + H2O é:
“Os metais alcalinos reagem violentamente com água, produzindo gás hidrogênio e soluções de hidróxidos de metais alcalinos. Em muitos casos geram calor suficiente para incendiar o H2, produzindo fogo ou explosão" (BROWN; LEMAY; BURSTEN, 2005, p.237). A liberação de calor nesta reação é maior para os elementos mais pesados do grupo, pois estes têm menor capacidade em manter o único elétron de valência. Assim, qual elemento do grupo dos metais alcalinos, ao entrar em contato com água, gerará a reação mais violenta?
A rotulagem do produto químico é um dos meios utilizados pelos fornecedores para transferir ao público-alvo as informações essenciais (incluindo o transporte, o manuseio, a armazenagem e as ações de emergência) sobre os seus perigos. Os símbolos abaixo representam, respectivamente:

O estagiário do laboratório de química, sob supervisão do técnico, preparou uma solução de hidróxido de sódio com concentração de 0,01 mol/L. Visto que essa solução foi utilizada em uma aula de medição de pH, qual o valor do potencial hidrogênio iônico dessa solução?
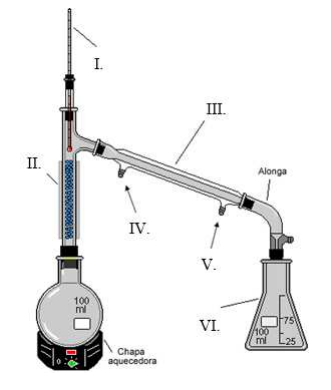
As destilações são métodos de separação de substâncias miscíveis, cujas temperaturas de ebulição não sejam muito próximas. Durante o aquecimento da mistura, é separada, inicialmente, a substância de menor temperatura de ebulição; depois, a substância com temperatura de ebulição intermediária, e assim sucessivamente, até a substância de maior temperatura de ebulição.
Analisando o sistema na figura a seguir, a afirmativa correta sobre o método e as indicações em algarismos romanos é: