A fórmula química de um composto representa sua composição em termos de símbolos químicos dos elementos que compõem uma determinada substância. A xantofila, uma substância encontrada em penas de aves e em flores, contém átomos de carbono, hidrogênio e oxigênio na razão 20:28:1. Sabendo que uma molécula desse composto tem seis átomos de oxigênio, qual é a fórmula química da xantofila?
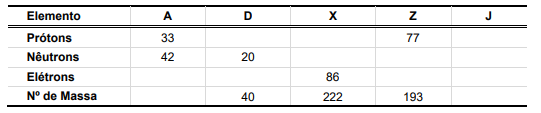
O avanço nas técnicas de análises de espécies químicas diversas permite o descobrimento de fenômenos importantes, como o ocorrido com a espectrometria de massas, técnica que permitiu identificar que átomos de um mesmo elemento podem apresentar massas diferentes. Essa observação foi definitiva para o refinamento do modelo nuclear, com a descoberta de uma nova partícula subatômica – o nêutron – e a identificação de isótopos. Considere a seguinte tabela:
Supondo que os elementos A, D, X, Z e J possam ocorrer na forma de isótopos, e com base nas informações contidas na tabela, é correto afirmar que:
A energia livre de Gibbs (G) é uma função de estado termodinâmica que combina as duas funções de estado, entalpia (H) e entropia (S). Para processos que ocorrem a temperatura constante, tem-se que ∆G = ∆H – T∆S. Para um processo ou reação ocorrendo a temperatura e pressão constantes, o sinal de ∆G relaciona-se à espontaneidade do processo. Nesse sentido, sobre a termodinâmica das reações químicas, identifique como verdadeiras “V" ou falsas “F" as seguintes afirmativas:
( ) Se ∆G = 0, a reação não ocorre.
( ) Uma reação espontânea ocorre em qualquer sentido (direto e indireto).
( ) Se ∆G < 0, a reação é espontânea no sentido direto (reagentes -> produtos).
( ) Se ∆G > 0, a reação é espontânea no sentido indireto (produtos -> reagentes).
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A concentração dos vapores oriundos de uma solução ideal contendo dois ou mais componentes voláteis pode ser diferente das concentrações dos componentes em solução. Assim, as pressões parciais dos vapores acima da solução serão dadas pela Lei de Raoult, e a pressão vapor total (Ptotal) será a soma das pressões parciais de cada componente. Considere como ideal uma mistura a 20 ºC contendo 1,0 mol de benzeno (Pº = 75 torr) e 2,0 mols de tolueno (Pº = 22 torr). Qual é a pressão de vapor total, em torr, sobre essa solução?
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
A natureza química da água faz desta um excelente solvente para moléculas apolares.
No processo de dissolução de um soluto molecular em um líquido, as forças de atração entre as moléculas do soluto e do solvente devem ser
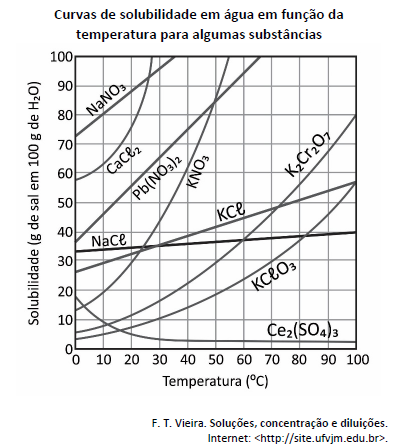
Deseja‐se preparar duas soluções saturadas na temperatura de 20 ºC, uma contendo o sal menos solúvel e outra contendo o sal mais solúvel nessa temperatura. Para cada uma das soluções, será empregado o mínimo possível dos sais e será utilizado 1 L de água, mantida a 20 ºC durante todo o processo de dissolução. A massa específica da água é igual a 1.000 kg m−3. Com base nesse caso hipotético e no gráfico, assinale a alternativa que apresenta, correta e respectivamente, as massas aproximadas dos dois sais necessárias para o preparo dessas soluções.
Pelo modelo de repulsão de pares de eletrônicos da camada de valência, regiões de densidade eletrônica aumentada assumem posições tão separadas quanto possível e a geometria da molécula é identificada, referindo‐se às localizações dos átomos na estrutura resultante. Conforme esse modelo, a geometria da molécula de SF6 é
Do ponto de vista prático, mais importante que a velocidade das reações químicas, tradicionalmente estudadas na cinética química, é a velocidade dos processos que incluem, além da reação química, outras condições, como, por exemplo, a velocidade de difusão dos reagentes até o locus de reação. Nesse contexto, a Figura 1 mostra o gráfico da combustão da vela n.º 1 (11 gramas e 2 cm de raio), que apresenta o tempo de consumo em ambiente aberto (com circulação de ar) e fechado (sem circulação de ar) e a regressão linear para ambos os ambientes. A Figura 2 apresenta o gráfico do processo de combustão em ambiente aberto e fechado e a regressão linear de ambos os ambientes para a vela n.º 3 (17 gramas e 2 cm de raio).
Acerca da variação na velocidade de queima das velas, assinale a alternativa correta.
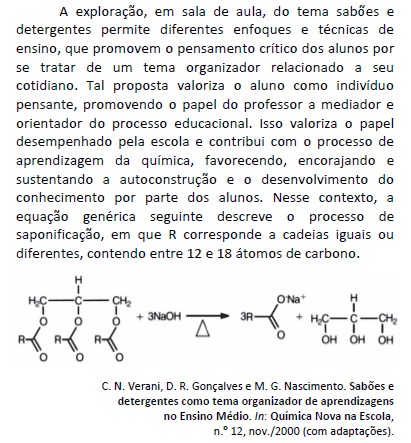
O processo de limpeza com o uso de sabões pode ser prejudicado se for realizado em água dura por se tratar de água
No que se refere à lei periódica dos elementos, assinale a alternativa correta.
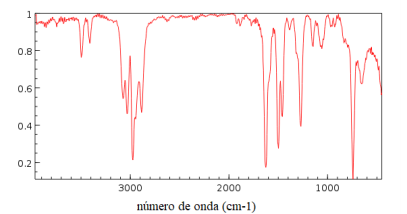
Indique, dentre as substâncias listadas nas alternativas, aquela cujo espectro de infravermelho com transformada de Fourier corresponde ao apresentado a seguir:
O rótulo de um frasco encontrado em um armário velho de um laboratório indicava apenas que se tratava de uma solução de ácido sulfúrico, sem indicação da concentração. A fim de determinar a concentração desconhecida, uma amostra de 5,0 mL desta solução foi diluída a 100 mL e, em seguida, titulada com solução de hidróxido de sódio, a 0,20 mol/L. Sabendo que foram consumidos 50 mL de solução alcalina até o ponto de equivalência, indique a alternativa que apresenta a concentração da solução de ácido sulfúrico presente no referido frasco.
A cromatografia gasosa é um método físico de separação dos componentes de uma mistura através de uma fase gasosa móvel sobre um adsorvente estacionário. Depois de separados, os componentes da mistura podem ser quantificados por um detector adequado, situado na saída da coluna de separação. Sobre as características dos diversos tipos de detectores, NÃO é correto afirmar:
A cromatografia líquida de alta resolução (HPLC) é uma técnica utilizada na análise de compostos tóxicos. Uma vez aceito o material para análise, o químico deve preparar a amostra para injetar no cromatógrafo, de forma que preencha os seguintes requisitos, EXCETO: