Os átomos interagem entre si através de ligações químicas. Essas incluem as ligações covalentes que definem a estrutura das moléculas e as ligações não covalentes que são de grande importância para a bioquímica como, por exemplo, na replicação do filamento do DNA e no enovelamento de proteínas para formas tridimensionais.
São ligações não covalentes, EXCETO:
A acidez de uma solução é definida pela concentração de íons H+. Considerando-se essa afirmação, assinale a alternativa que corresponde a uma substância capaz de transformar uma solução ácida em uma solução básica.
Sempre que se liga um aparelho de CD portátil ou um computador portátil, completa-se um circuito que
permite que uma reação química ocorra em uma bateria – uma descendente direta da pilha de Volta de metais e papel. As pilhas e baterias são exemplos de células eletroquímicas.
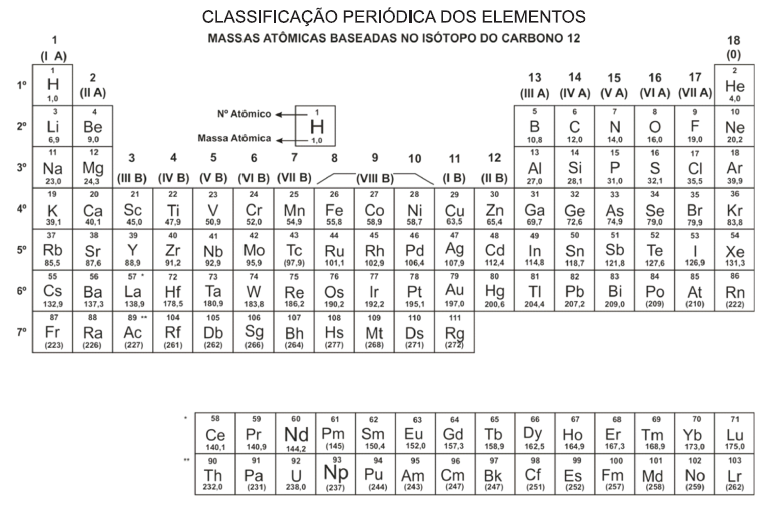
Considere que uma pilha hipotética de dois metais X e Y tem a seguinte representação simbólica: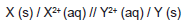 Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e
Quantitativamente, os potenciais de redução dos eletrodos foram mensurados em valores de –1,0 V e
–3,0 V.
Com base nessas informações, assinale a alternativa em que a característica dessa pilha está incorreta.
Numa embalagem contendo maçãs do tipo Gala, lê-se: 100g de maçã contém 85g de água, 116mg de potássio e 12mg de fósforo, além de cálcio, cloro, sódio e magnésio. Os símbolos de dois dos elementos citados na embalagem são
Uma unidade de concentração é composta por uma unidade de
Na gravimetria por precipitação, o analito é separado de uma solução de uma amostra como um(a)
A eluição por gradiente melhora a separação dos componentes da matriz em métodos de cromatografia líquida e pode-se obter esse gradiente por aumento do/da
A ciência dos materiais proporciona uma gama variada de compostos para aplicação em diferenciados ramos. Para tanto, a ciência dos materiais se apropria das características físicas e químicas da matéria para adequar as combinações úteis entre diferentes substâncias. Um exemplo desta combinação é a liga metálica estanho – chumbo que é utilizada em soldas para circuitos elétricos, entre outras utilidades. Esta liga tem como principal característica a fusão de ambos os metais simultaneamente. Analise gráfico a seguir e responda. A liga estanho – chumbo é um exemplo de?
Uma aproximação bastante difundida sobre a velocidade das reações químicas diz que a velocidade de uma reação realizada a 25°C duplica quando a temperatura se eleva em 10°C, para as mesmas concentrações de reagentes. Dessa forma, calcule a energia de ativação das reações que obedecem exatamente à afirmativa apresentada. Dados: R = 8,31 J.K-1 .mol-1 ; ln 2 = 0,7
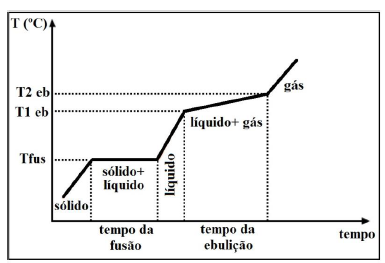
Um estudante do IFMS montou uma cela galvânica (pilha) conforme esquema a seguir:
Legenda da figura: (A) placa de estanho, (B) solução aquosa contendo íons Sn2+, (C) placa de alumínio, (D) solução aquosa contendo íons Aℓ3+, (E) fio metálico, (F) resistência elétrica e (G) ponte salina. Considerando os seguintes dados:
E°(Sn2+ +/Sn) = -0,14 V
E°(Aℓ3++/Aℓ) = -1,68 V
Durante o funcionamento da pilha, o estudante fez algumas afirmações:
I. A concentração de íons alumínio aumenta na solução da direita (D).
II. Na placa de alumínio ocorre a corrosão.
III. O fluxo de elétrons ocorre pelo fio metálico a partir da placa de estanho em direção à placa de alumínio. IV. Na placa de estanho ocorre a redução. V. A placa de estanho é o polo negativo da cela galvânica.
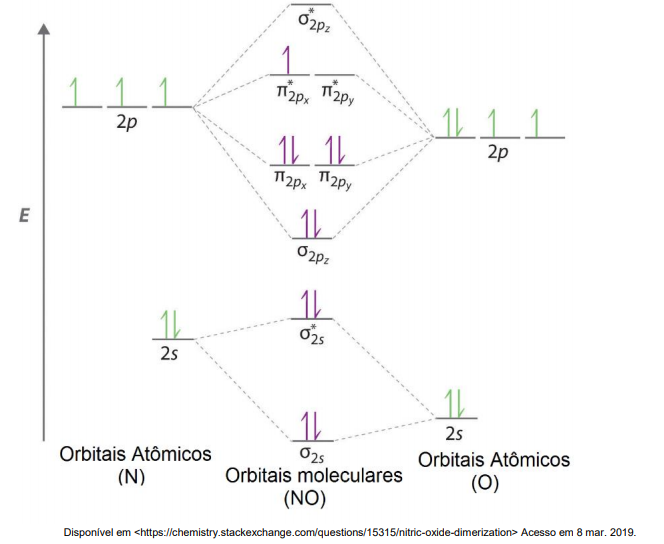
A Teoria dos Orbitais Moleculares (TOM) é uma ferramenta útil na descrição de ligações químicas, na avaliação da estabilidade química e na previsão de propriedades físicas das moléculas como absorção de luz e magnetismo. Utilizando o conceito de ordem de ligação (OL) [OL = (EOL - EOAL) / 2 ], em que EOL é o número de elétrons em orbitais ligantes e EOAL é o número de elétrons em orbitais antiligantes, é possível avaliar qualitativamente a estabilidade de uma determinada molécula. Abaixo segue o diagrama de orbitais moleculares para o óxido nítrico (NO), que no estado gasoso é uma molécula paramagnética.
Em eletroquímica, definimos potencial de junção como a
O nitrogênio (Z = 7) tem a configuração [He]2s22p1 x2p1 y2p1 z e o oxigênio (Z = 8), que aparece um orbital 2p duplamente ocupado, resulta [He]2s22p2 x2p1 y2p1 z. O conceito que explica quando os elétrons ocupam isoladamente um orbital é chamado de
O agente mais comum e mais utilizado na purificação da água na América do Norte é o ácido hipocloroso. Uma importante desvantagem do uso da cloração para desinfecção de águas é a formação de subprodutos, substâncias orgânicas potencialmente tóxicas. Assinale a alternativa que não apresenta um subproduto de cloração.
A química ácido-base de muitos sistemas de águas naturais, que inclui rios e lagos, é dominada pela interação do íon carbonato com o ácido carbônico, sendo o equilíbrio entre as espécies dependente do pH do meio. No gráfico abaixo, as espécies predominantes no sistema carbonato estão representadas por números 1, 2 e 3. Observando o gráfico, assinale a alternativa que correlaciona a numeração com a espécie, respectivamente.
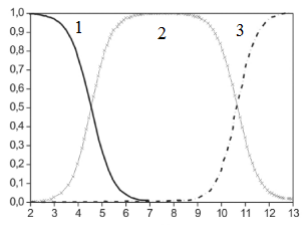
pH
Figura 01 – Diagrama das espécies para o sistema carbonato. Fração do carbono como espécies determinadas x pH. Fonte: Baird, 2011.