Em uma reação química a variação da entalpia é sempre a mesma, quer ela ocorra em uma única etapa ou em várias. A variação da entalpia depende somente dos estados inicial e final. Esse conceito é conhecido como a lei de:
Considere as assertivas abaixo e leve em consideração o preenchimento dos orbitais
moleculares:
Assinale a alternativa com as assertivas VERDADEIRAS:
Na maioria das condições, os gases com que lidamos na realidade se desviam da lei dos
gases ideais. Portanto, considere uma amostra de 1,00 mol de dióxido de carbono, CO2, com
uma pressão de 5,00 atm e um volume de 10,0 L, e a seguir julgue os itens (V ) se forem
verdadeiros ou (F ) se forem falsos. Considere as constantes de van der Waals, a = 3,6 atm L2
mol-2 e b = 0,042 L moL-1.
I. ( ) A temperatura dessa amostra de gás usando a lei dos gases ideais é aproximadamente 336,7 0C.
II. ( ) A temperatura dessa amostra de gás usando a lei dos gases ideais é aproximadamente 609,7 K.
III. ( ) A temperatura dessa amostra de gás usando a lei dos gases reais é aproximadamente 611,5 K.
IV. ( ) A temperatura do gás real é aproximadamente 1,8 graus mais alta do que a da lei dos gases ideais.
V. ( ) A constante de van der Waals b representa a correção da pressão e está relacionada à magnitude das interações entre as partículas do gás.
VI. ( ) A constante de Van der Waals a representa a correção do volume e está relacionada ao tamanho das partículas do gás.
Assinale a alternativa CORRETA:
A partir da decomposição térmica de uma reação química hipotética, XZK3(s) → XK(s) + ZK2(g), o volume de gás produzido nas CNTP, considerando 100 g do composto XZK3 é (dados: X = 40 u; Z=12 u; K= 16 u):
Considere um cilindro provido de um pistão móvel, que se desloca sem atrito, contendo 1,0 mol de um gás A que ocupa um volume de 20,0 L sob pressão 1,2 x 105 N m-2. Mantendo a pressão constante, a temperatura do gás é diminuída de 15 K e o volume ocupado pelo gás A diminuído para 19,2 L. Assim, a variação da energia interna neste sistema é aproximadamente igual a _________. Considere a capacidade calorífica molar do gás A à pressão constante igual a 20,8 J K-1 moL-1.
Albert Einstein (1879 – 1955) nasceu em Ulm, no antigo estado alemão de Wüttemberg. Antes
de se tornar professor foi funcionário de um escritório de patentes suíço. O ano era 1905,
conhecido como miraculoso ano de Einstein. Nesta época, ele publicou artigos no periódico
alemão Anais da Física (Annalen der Physik) que revolucionaram a ciência. No primeiro artigo,
ele estudou o fenômeno do quantum (a unidade fundamental de energia). Neste artigo, foi
explicado o efeito fotoelétrico segundo o qual para cada elétron emitido, uma quantidade
específica de energia é usada. Por esse estudo, Einstein ganhou o prêmio Nobel de física de
1921 . Seu segundo artigo foi “Sobre uma nova determinação das dimensões moleculares” e, o
terceiro, “Sobre o movimento de pequenas partículas suspensas em líquidos estacionários
exigido pela teoria molecular cinética do calor”. Ele propôs um método para determinar o
tamanho e movimento dos átomos. O último de seus artigos, intitulado “Sobre a
eletrodinâmica dos corpos em movimento”, Einstein introduziu o que viria a ser conhecido
como a teoria da relatividade geral (Os gênios da ciência – sobre os ombros de gigante,
Elsevier, Editora Campus, Stephen Hawking).
Utilizando o efeito fotoelétrico de Einstein e o valor da constante de Planck (h) igual a 6,63 x
10-34 J s, calcule a energia de um fóton amarelo cujo comprimento de onda é 589 nm.
Ana Júlia é uma ambientalista do Greenpeace. Seu pai é um técnico em química formado no Instituto Federal de Alagoas. A menina usa a bicicleta como meio de locomoção e gosta de propor desafios estequiométricos para seu pai. Um dia eles resolvem ir visitar os parentes em Junqueiro, cidade localizada na região centro-sul do Estado de Alagoas, distante 125 Km da capital Maceió. Em virtude do aquecimento global causado principalmente pelo lançamento de CO2 na atmosfera, Ana Júlia propõe ao pai intercalarem a viagem entre carro e bicicleta em função da massa de dióxido de carbono produzida no deslocamento. Sabe-se que o veículo de propriedade da família percorre 8 Km para cada litro de combustível e que a gasolina é composta somente de octano, C8H18(l), que possui densidade de 0,69 g mL-1. Analisando as sentenças, como deverá ocorrer a viagem de ida e volta, levando em consideração a massa de CO2 produzida a partir da combustão completa?
Considere as seguintes assertivas:
I. 25 mL de HNO3 0,4 mol L-1
neutraliza 100mL de solução 0,10 mol L-1
de KOH.
II. Sabendo que a densidade do etanol é 0,80 g mL-1
e que em 100 mL de gasolina temos
25% de etanol em volume. Podemos dizer que a concentração em quantidade de matéria
de etanol nessa solução é 4,3 mol L-1.
III. Na reação de neutralização de 40 mL de solução 1,5 mol L-1
de hidróxido de sódio com 60
mL de solução 1,0 mol L-1
de ácido clorídrico, podemos dizer que a concentração em
quantidade de matéria de Clnos
100 mL resultantes da mistura das soluções é igual a 0,6
mol L-1.
IV. O rótulo da embalagem do leite informa que em 300 mL temos 56 mg de cálcio. A
concentração de cálcio 0,031 mol L-1.
Assinale alternativa com a assertiva FALSA:
O rádio é um elemento muito raro, mas sua presença
é facilmente comprovada devido a sua
radioatividade. Como o seu núcleo se desintegra de
forma espontânea, todo rádio provém da fissão
nuclear de elementos mais pesados, principalmente
o urânio.
A meia-vida do isótopo 88Ra226 é igual a 1.620 anos. O
tempo, em anos, necessário para que a atividade de
uma amostra desse isótopo radioativo se reduza em
95% da inicial é:
Um brometo de alquila opticamente ativo e contendo 58,4% de bromo reage completamente com sódio metálico.Assim sendo, o composto obtido será:
0,2 g de uma liga de alumínio e magnésio, reagindo com excesso de ácido clorídrico, produzem 410 cm de gás hidrogênio (H2), medidos a 0,6 atm e 27 °C. Com base nas informações acima, a composição percentual de magnésio e alumínio na liga é, respectivamente, igual a: Dado: R = 0,082 atm.L.mol-1 .K-1 MA:Al = 27u; Mg = 24u
Uma amostra de 0,100 g de propano foi queimada com excesso de oxigênio em um calorímetro calibrado de pressão constante, cuja capacidade calorífera é de 520 J.C–1. Nessa experiência a temperatura do calorímetro aumentou 9,62ºC. Utilizando os dados apresentados, a entalpia de combustão do propano em kJ.mol–1 é aproximadamente: Dados: Massa molar (g.mol–1): H = 1 C = 12
A decomposição do NOCl pode ser descrita pela reação
elementar: 2NOCl(g) → 2NO(g)+Cl2(g).
Sendo a velocidade dessa reação dada em mol.L–1 . s–1, a sua
constante de velocidade será expressa em
O S-metolacloro é representado pela formula:
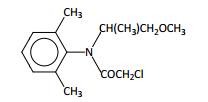
Este é o ingrediente ativo de um herbicida de use geral, aplicado no controle de ervas daninhas. Existem evidencias da contaminação de águas
subterrâneas e superficiais por esse herbicida e também de bioacumulag5o em peixes. Na estrutura do S-metolacloro estão presentes as funções orgânicas
As propriedades químicas de uma substância podem se relacionar
com o seu pKa determinado por métodos simples como titulação,
condutimetria e ultravioleta. Os valores dos pKa de três ácidos
carboxílicos foram determinados: ácido benzóico ( I), ácido‐p‐
metil‐benzóico (II ) e ácido‐p‐cloro‐benzóico ( III).
A ordem crescente dos pKa desses ácidos é


