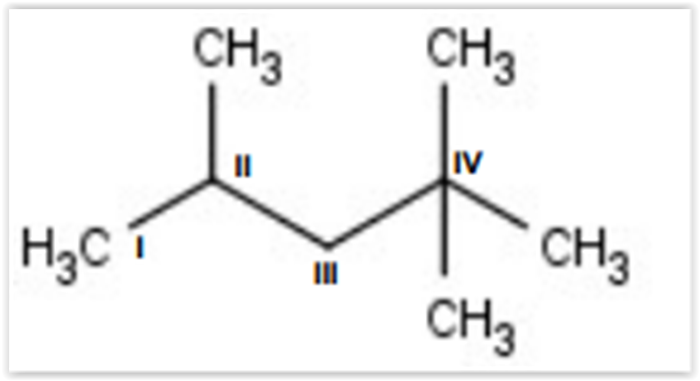
Sabendo que na estrutura do composto 2,2,4 trimetilpentano
representada abaixo, há carbonos que podem ser
classificados como primários, secundários, terciários e
quaternários, assinale a alternativa que apresenta a
classificação CORRETA dos carbonos I, II, III e IV,
respectivamente.
O leite de magnésia é uma suspensão de Mg(OH)2 em água. Esta suspensão dissolve-se com a adição de HCl, gerando uma solução final aquosa incolor que contém cloreto de magnésio. As funções químicas das substâncias Mg(OH)2, HCl e cloreto de magnésio, respectivamente, são
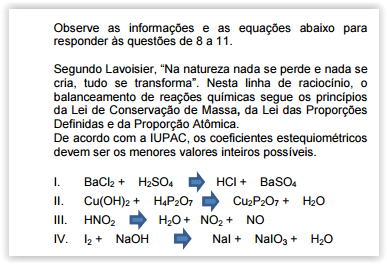
Faça o balanceamento das reações e, em seguida, assinale a alternativa que apresenta a soma dos coeficientes da reação II.
O mercúrio é um elemento químico de número atômico 80.
Pertence à classe dos metais de transição. Usado como
catalisador em reações químicas. Uma intoxicação pelo
vapor deste elemento pode apresentar sintomas como dor
de estômago, diarreia, tremores, depressão, ansiedade,
gosto de metal na boca, insônia, falhas de memória e
fraqueza muscular, nervosismo, mudanças de humor,
agressividade, dificuldade de prestar atenção e até
demência. Mas pode contaminar-se também através de
ingestão. No sistema nervoso, o produto tem efeitos
desastrosos, podendo causar lesões leves e até a vida
vegetativa ou levar à morte, conforme a concentração.
Com base nisso, em caso de acidente, os primeiros
socorros são,
I. em caso de inalação: transladar a vítima para o ar
fresco; buscar auxílio médico.
II. em caso de contato com a pele: retirar a roupa
contaminada, lavar a área afetada com água e
sabão; buscar auxílio médico.
III. em caso de contato com os olhos: lavar
imediatamente os olhos com água; buscar auxílio
médico.
IV. em caso de ingestão: enxaguar a boca com água;
buscar auxílio médico.
É correto o que está contido em
A carga nuclear consiste no número de prótons do núcleo
atômico e é igual ao número atômico do elemento químico
correspondente. Os nêutrons, também presentes no
núcleo de um átomo, contribuem para a massa atômica,
mas não para a carga nuclear. Desta forma, é correto
afirmar que
I. o átomo de hidrogênio possui 1 próton e 1 nêutron
no seu núcleo.
II. a carga nuclear do átomo de hidrogênio é +1
III. o número atômico do hidrogênio é 1
É correto o que está contido em
20 mL de uma amostra de peróxido de hidrogênio
comercial é diluída com água a 250 mL. Uma alíquota
de 25 mL da solução diluída consome, até reação
completa, 41 mL de permanganato de
potássio 0,085N. A concentração da solução original,
em porcentagem de H O , em massa/volume é:
Dado:
KMnO4 +H2O2 +H2SO4 > K2SO4 +H2 SO4+H2O+O2
As aminas são as bases por excelência dentro da
química orgânica, porque o nitrogênio presente em
sua estrutura apresenta par de elétrons disponíveis,
capturando prótons (base de Lewis).
A presença de radical elétron-repelente ligado ao
nitrogênio vai aumentar sua densidade eletrônica,
facilitando a retirada do íon H da molécula de água.
H3 N: + H:OH > NH+4 OH-
Com base no exposto, pode-se afirmar:
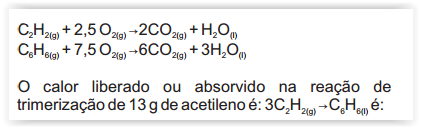
A combustão total de 2,6 g de acetileno (C2H2) libera
130 kJ. A combustão total de 3,9 g de benzeno (C6H6)
libera 165,8 kJ.
Dado:
Quando se opta pela utilização do sistema de cogeração como alternativa para a geração de eletricidade, tendo em vista o seu tempo de implantação, tem-se, em mente, a aplicação de conceitos de
Com relação aos usos industriais do gás natural, é correto afirmar:
A reação de decomposição da água oxigenada,
é uma reação de oxirredução na qual o elemento
Certa porção de raspas de ferro foi acrescentada a 100 mL de solução aquosa 3 mol/L de ácido sulfúrico, ocorrendo a reação representada por:
Ao término da reação, o ácido foi totalmente consumido, sobrando ferro sem reagir. A solução resultante passou por um processo controlado de evaporação, obtendo-se o sal hidratado FeSO42 O. A massa do sal hidratado obtida deve ter sido, em gramas, aproximadamente igual a
O escurecimento de objetos de prata, como baixelas e talheres, é muito comum. Ao se cozinhar demasiadamente os ovos, as proteínas da clara, que contêm átomos de enxofre, liberam o ácido sulfídrico, que na forma gasosa e na presença de oxigênio, na água de cozimento, pode levar à oxidação do objeto de prata, com formação de uma fina camada insolúvel de sulfeto de prata (Ag 2S). O mesmo ocorre quando se cozinham alimentos como o repolho, que contém compostos sulfurados como a cisteína, estrutura representada na figura, que sofre decomposição durante o cozimento, liberando o H2S. As principais reações envolvidas nesse fenômeno são apresentadas nas equações:
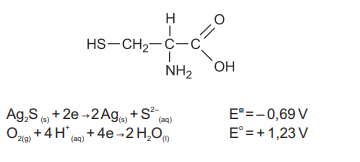
A diferença de potencial (ddp) para a reação global que representa o fenômeno do escurecimento dos objetos de prata tem valor igual a:
Atualmente, a emissão de poluentes por automóveis está sendo controlada dentro de rígidas normas. Para isso, já estão sendo colocados catalisadores em automóveis novos. Esses catalisadores aceleram as reações químicas que transformam os poluentes (CO, NO ) em compostos menos prejudiciais à saúde (CO , H O, N ). Como, por exemplo, a reação que ocorre com liberação de calor:
2 NO2(g) + 4 COg N2(g) + 4 CO2(g) + calor
A respeito dessa reação, fazem-se as seguintes afirmações:
I. Um aumento da temperatura da mistura gasosa favorece a produção de gases prejudiciais à saúde.
II. Um aumento da pressão parcial do gás dióxido de nitrogênio no sistema favorece a produção de gases menos prejudiciais à saúde. III. Um aumento da pressão total sobre o sistema favorece a produção de gases menos prejudiciais à saúde.
Está(ão) correta(s) a(s) afirmativa(s):
Desde 2003 são usados no Brasil tomógrafos que utilizam o radioisótopo flúor-18, cuja meia-vida é relativamente curta (108 min); por isso a produção de flúor-18 deve ser realizada próximo ao hospital que possui o aparelho. Supondo que esse aparelho utilize uma massa de 0,5 g de flúor-18, em quanto tempo sua massa seria reduzida a 0,0625 g?