O hidrogênio é um elemento incomum, porque se comporta algumas vezes como os
metais alcalinos e, outras vezes, como um não metal.
Analise as seguintes afirmações a respeito do elemento químico hidrogênio.
I. A afinidade eletrônica do hidrogênio é mais próxima dos valores para os metais
alcalinos do que para os halogênios.
II. O hidrogênio tem menor raio atômico covalente entre quaisquer elementos que
formem compostos químicos.
III. A energia de ionização do hidrogênio é mais próxima dos valores para os metais
alcalinos do que para os halogênios.
A partir dessa análise, conclui–se que estão CORRETAS as afirmativas.
Considere que 0,5 g de uma amostra de sal de cozinha (NaCl) foi dissolvida em água
destilada. Adicionou–se, nessa solução, um excesso de AgNO3, obtendo–se 0,9 g de um
precipitado branco que escurece sob ação da luz.
A partir dessas informações, é CORRETO afirmar que o grau de pureza do sal é
aproximadamente de
Uma solução de 100 mL ácido clorídrico tem pH igual a 1
Após adicionar, em tal solução, 100 mL de uma solução 0,2 mol/L de NaOH, qual será o
novo pH da mistura reacional?
Considere os seguintes dados: log2 = 0,3
A tabela abaixo mostra o nome dos compostos e suas respectivas temperaturas de
ebulição à pressão atmosférica.
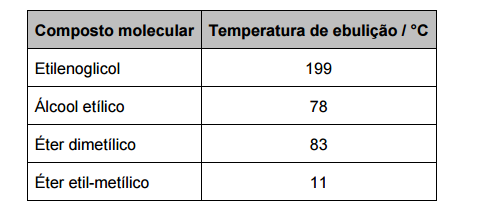
Com relação aos compostos citados, é CORRETO afirmar que
Os tamanhos relativos do quociente da reação Q e da constante de equilíbrio K indicam a
direção para a qual a reação tende a mudar. Para conhecer a tendência de uma
determinada mistura de reagentes e produtos de formar mais produtos ou mais reagentes,
é necessário comparar Q e K.
Com relação às tendências de formar, no equilíbrio, mais produtos ou mais reagentes, é
INCORRETO afirmar que
O composto inter–halogênio BrF3, é um líquido volátil cor palha. O composto exibe
apreciável condutividade elétrica devido à auto–ionização. A equação química abaixo
representa o processo de auto–ionização do BrF3.
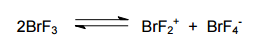
Com relação aos produtos formados (BrF2+ e BrF4–) da auto–ionização do BrF3, suas
estruturas geométricas são, respectivamente,
Uma amostra de 100,0 mL de água foi alcalinizada com amoníaco, e o sulfeto nela
contido foi titulado com 15 mL de AgNO3 0,1 mol/L. A reação analítica é
2Ag+(aq) + S2–(aq) → Ag2S(s)
Considerando–se essas informações, é CORRETO afirmar que a quantidade em massa
de H2S na água é
Uma solução de sacarose (C12H22O11) foi preparada, utilizando 10 g do soluto e 100 g de
água. A pressão de vapor da água pura a 20 ºC é 17 Torr.
A partir dessas informações, é CORRETO afirmar que a pressão de vapor da água na
solução de sacarose a 20 ºC é
São compostos quirais, EXCETO:
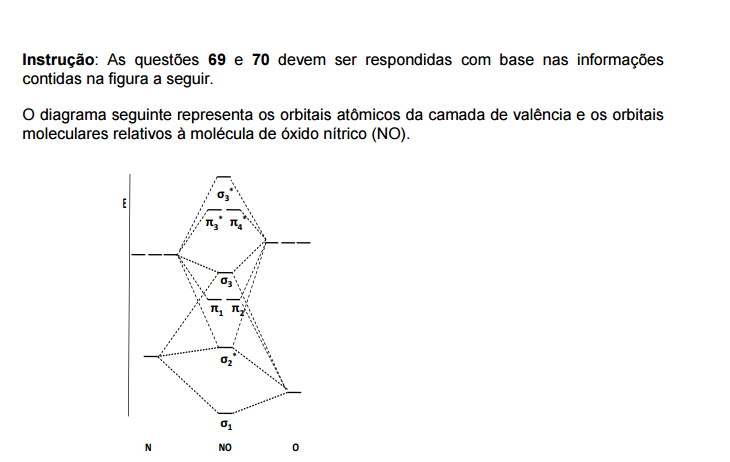
Com base no diagrama e no conhecimento de orbitais moleculares, é CORRETO afirmar
que a ordem de ligação total do NO é
Considere a reação abaixo com o valor da energia livre de Gibbs padrão da reação a
25ºC.
2SO2(g) + O2(g) → 2SO3(g) ΔG0 = –141,74 kJ.mol–1
A partir dessas informações, é CORRETO afirmar que a energia livre de Gibbs de reação,
quando a pressão parcial de cada gás é 100 atm, será
Os habitantes de uma comunidade geram uma contribuição per capita de DBO de 64
g/hab de uma contribuição per capita de esgoto de 165L/hab.d.
Usando a formula abaixo:
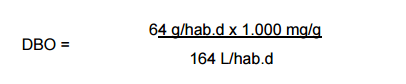
O valor resultante da DBO será expresso em
Uma propriedade que é associada a líquidos é a capacidade de
molhar outras coisas. A molhabilidade é o espalhamento de um
líquido ao longo de uma superfície para formar uma película.
Para que a molhabilidade ocorra, as atrações no interior do
próprio líquido devem ser tão fracas a ponto de serem facilmente
suplantadas pela atração líquido-superfície.
Assinale a opção que indica, entre os líquidos, o que apresenta
maior molhabilidade.
O glifosato é um herbicida não seletivo (mata qualquer tipo de
planta) desenvolvido para matar ervas, principalmente perenes.
Seu efeito no organismo humano é cumulativo e a intensidade da
intoxicação depende do tempo de contato com o produto. O
herbicida pode continuar presente em alimentos num período de
até dois anos após o contato com o produto e em solos por mais
de três anos, dependendo do tipo de solo e clima.
Uma amostra de glifosato 5,07mg apresentou a seguinte
composição: 1,08mg de C; 0,24mg de H; 0,42mg de
N; 0,93mg de P e 2,4mg de O. A fórmula empírica dessa
substância é
Dados: Massa molar H=1g.mol–1 C=12g.mol–1 N=14g.mol–1
O = 16g.mol–1 P = 31g.mol–1
Para a reação 2 N2O5(g) → 4 NO2(g) + O2(g), a 298K, é 3,38x10–5s–1
Considerando a cinética desta reação, assinale V a afirmativa
verdadeira e F para a falsa.
( ) Espera-se um decaimento exponencial do reagente, uma vez que a lei de velocidade da reação pode ser expressa por v = k [N2O5].
( ) A reação segue a cinética de segunda ordem.
( ) Um catalisador apropriado poderá aumentar a velocidade da reação uma vez que diminui a diferença de energia livre de Gibbs da reação.
As afirmativas são, respectivamente,