Determinado estudante preparou uma solução de 250 mL de uma solução contendo 80 g/L de NaOH. Considerando essa situação hipotética, assinale a alternativa correta quanto à quantidade de água que deverá ser adicionada a essa solução, para que sua concentração mude para 0,80 M. Dado: MA(g/mol) [Na = 23; O = 16; H = 1]
Considere a reação aX + bY → cZ + dW. Quando a
concentração de Y dobra, a velocidade da reação dobra;
quando as concentrações de X e Y dobram, a velocidade
aumenta por um fator de 8. Nessa situação, a equação que
melhor descreve a lei da velocidade é a seguinte:
Assinale a alternativa que determina as pressões parciais
aproximadas dos componentes gasosos contidos em um
tanque comportando 440 g de CO2 e 290 g de butano
(C 4H10), considerando que o sistema está submetido à
temperatura de 350 ºC e pressão de 2,5 atm.
Dado, MA(g/mol): C = 12; H = 1; O = 16.
Considerando MA(g/mol): Na = 23; C = 12; O = 16, a massa
necessária de Na2CO3 para preparar 200 mL de uma solução
com concentração igual a 0,25 mol/L, em íons Na+, é
Dentre as técnicas mais modernas de descontaminação de um solo, existe um processo no qual organismos vivos, normalmente plantas ou microrganismos, são utilizados tecnologicamente para remover ou reduzir poluentes no ambiente. Esse processo é denominado:
Assinale a alternativa que NÃO apresenta uma vantagem da colheita mecanizada da cana-de-açúcar no processo de produção de etanol.
Todo sólido puro possui ponto de fusão definido e reprodutível. Assim sendo, a presença de um contaminante (impureza) em uma amostra sólida altera a temperatura de fusão. Na avaliação de pureza absoluta pelo método da Equação de van't Hoff, que determina a pureza a partir do pico de fusão do analito, sabe-se que, em geral, quanto maior a concentração de impurezas na amostra:
As formulações de detergentes mais atuais substituíram os catalisadores usuais por enzimas, catalisadores biológicos, pois a
maioria dos usuais agredia o meio ambiente, sendo tóxicos e provocavam o desgaste de materiais e de instrumentos. Estas
enzimas têm a grande vantagem de serem 100% biodegradáveis. Dessa forma, uma nova geração de detergentes sem fosfato
e sem cloro alvejante, contendo apenas enzimas, com formulação mais segura e menos cáustica, tem sido utilizada, mas com
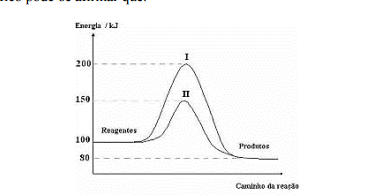
o mesmo desempenho. O gráfico abaixo exemplifica o efeito de um catalisador sobre a rapidez de uma mesma reação
química. Após a análise do gráfico pode-se afirmar que:
O carbeto de cálcio apresenta fórmula química CaC2. É usado em alguns tipos de maçaricos oxi-acetilênicos, nos quais reage com a água produzindo acetileno (etino) que é usado na fabricação dos seguintes materiais: explosivos, solventes industriais e plásticos de borracha sintética. Este composto também é empregado na síntese de compostos orgânicos como ácido acético (oxidação) e álcool etílico (redução). O acetileno ao ser hidratado se converte em etanal, o qual pode sofrer oxidação (obtendo o composto X) ou redução (obtendo o composto Y).Se X e Y são compostos orgânicos oxigenados, a nomenclatura oficial da IUPAC do composto orgânico z, resultante da reação de X com Y é:
A recristalização é um método de purificação de compostos orgânicos que são sólidos à temperatura ambiente. O princípio deste método consiste em dissolver o sólido em um solvente quente e logo esfriar lentamente. Na baixa temperatura, o material dissolvido tem menor solubilidade, ocorrendo o crescimento de cristais. Se o processo for lento ocorre a formação de cristais, chamando-se, então, de cristalização, e, se for rápida, chamando-se de precipitação. O crescimento lento dos cristais, camada por camada, produz um produto puro, fazendo com que as impurezas fiquem na solução. Quando o esfriamento é rápido, as impurezas são arrastadas junto com o precipitado, produzindo um produto impuro. Assim, o fator crítico na recristalização é a escolha do solvente. Na técnica de recristalização, um solvente pode ser classificado como bom quando:
Sobre as ligações químicas, analise as afirmativas.
I. Nas estruturas de Lewis, a ligação covalente resulta do compartilhamento de um par de elétrons entre dois átomos. Esse compartilhamento é uma característica particular das ligações encontradas na maioria das moléculas orgânicas.
II. Com o desenvolvimento da mecânica quântica, Linus Pauling introduziu o conceito de ressonância para explicar o tipo de situação, em que duas possíveis estruturas de Lewis coexistiriam sob a forma de estruturas ressonantes. Por exemplo, a representação das ligações no O3 é uma média de duas estruturas ressoantes possíveis.
III. Quando ocorre a ligação química pela transferência de elétrons de um átomo (que fica positivo) para outro átomo (que fica negativo), a ligação formada denomina‐se ligação iônica.
Está(ão) correta(s) a(s) afirmativas
No laboratório de química orgânica são realizados, constantemente, diversos processos químicos. Analise os dois processos que representam duas reações orgânicas muito comuns:
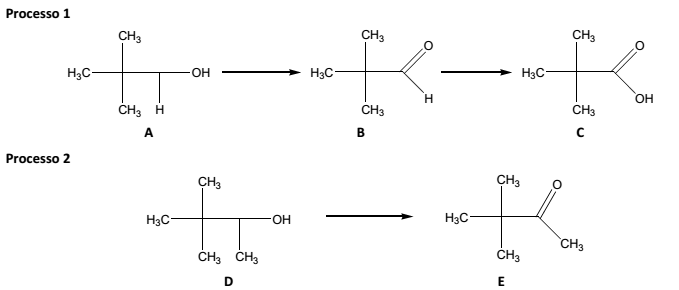
Diante do exposto, é INCORRETO afirmar que o composto
Numa titulação é preciso saber com precisão quando a solução que está sendo padronizada reagiu completamente com o padrão primário. Sobre o ponto final da reação, analise as afirmativas.
I. Ponto de equivalência ou ponto final teórico corresponde ao ponto da titulação em que é adicionada a quantidade de reagente padrão exatamente equivalente à quantidade de analito.
II. É calculado com base na estequiometria da reação envolvida na titulação.
III. Ponto final é o ponto da titulação onde ocorre uma alteração física associada à condição de equivalência. É indicado pela súbita mudança de alguma propriedade física da solução.
IV. A determinação do ponto final pode ser feita pelo uso de indicadores visuais que causam mudança na cor da solução num ponto muito próximo ao ponto de equivalência.
V. A determinação do ponto final pode ser feita, ainda, por métodos instrumentais e respondem a certas propriedades da solução, que mudam de características durante a titulação, tais como: medida de pH, condutividade, potencial, corrente, temperatura, absorbância etc.
Estão corretas as afirmativas
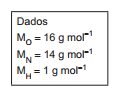
A hidrazina, N2 H4 , na forma líquida, usada como combustível, é carregada em um dos tanques de um foguete. Para que o foguete seja impulsionado, deve ocorrer a reação com oxigênio, O2 , também na forma líquida, presente em um outro tanque do foguete. A reação ocorre numa câmara, logo acima dos propulsores, na proporção de 1 mol de N2 H4 para 1 mol de O2 , gerando dois produtos, sendo um deles o gás nitrogênio, N2 . Considerando-se que um foguete carrega 3.200 kg de hidrazina, a massa mínima de oxigênio, em kg, que o foguete tem de levar, de modo a reagir com toda a hidrazina existente, e o segundo produto da reação são, respectivamente,
O estudo da tabela periódica mostrou que um grande número de propriedades físicas e químicas variavam conforme a variação do número atômico dos elementos químicos. Estas propriedades são as chamadas propriedades periódicas. Assinale a alternativa INCORRETA acerca das propriedades periódicas.
(Considere apenas elementos neutros e desconsidere os íons.)

