Você já deve ter notado que a água oxigenada é
comercializada em frascos escuros ou em plásticos
opacos. Isso se deve ao fato de a luz ser um dos
fatores responsáveis pela sua decomposição
(fotólise), na qual ocorre a liberação de gás
oxigênio. Assim, as concentrações das soluções de
água oxigenada são definidas em função do volume
de O2(g ) liberado (medido nas CNTP) por unidade
de volume da solução. Dessa maneira, água
oxigenada de concentração 10 volumes libera 10
litros de O2(g ) por litro de solução. Para obtermos 1
litro de uma solução de água oxigenada a 10
volumes, qual é a massa (m ) de H2O2 que devemos
dissolver em água, que irá liberar, na sua
decomposição, 10 litros de O2, medidos nas CNTP?
Para atender aos procedimentos de rotinas
laboratoriais, usamos vários tipos de soluções e
concentrações. Para exemplificar, um técnico
adicionou 100 mL de água destilada em 10 g de
composto S, em pó e seco (CaCO3). A partir dos
dados, obtiveram-se os resultados: (densidade da
água, ? = 1 g mL–1; massa molar do CaCO3 = 100 g mol–1 ):
I. Concentração comum: C = 0,1 g mL–1.
II. Concentração molar: [X] = 0,5 mol L–1.
III. Concentração molal: b = 1 mol kg–1.
IV.Concentração percentual: %C = 10% m/V.
V. Fração molar de S: XS ≈ 0,1.
Assinale a alternativa correta:
Em qualquer laboratório químico existem vidrarias diversas, equipamentos simples e complexos que auxiliam os usuários na preparação e medidas de caracterizações de amostras de distintas origens. Em relação aos equipamentos, é CORRETO afirmar que:
A seguir são apresentados itens com as reações de
equilíbrio e as correspondentes constantes de
equilíbrio em termos de concentração (Kc)
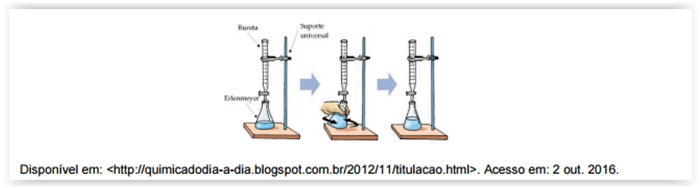
A figura ilustra o processo de análise volumétrica que consiste na determinação da
concentração ou da quantidade de substância pela medida de volume, podendo ser
interpretada como uma
Um técnico em análises químicas recebeu uma amostra de 0,101g de minério de
ferro e supôs que a porcentagem de massa de ferro na amostra era superior a 20%. Para
comprovar sua suposição, ele optou por dissolver a amostra em meio ácido e realizar uma
titulação com solução aquosa 0,005 mol/L de permanganato de potássio. Foram consumidos
10,5 mL do titulante. A equação não balanceada que representa a reação é dada abaixo.
O ponto estequiométrico pôde ser percebido pela cor persistente do íon permanganato,
indicando a transformação total do Fe (II) em Fe (III). A partir desses dados, é possível
concluir que o técnico em química estava
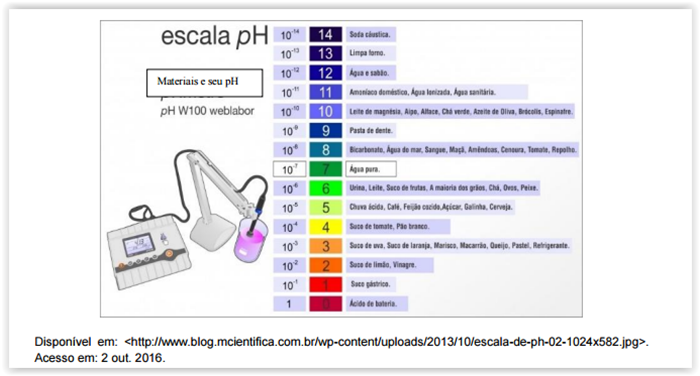
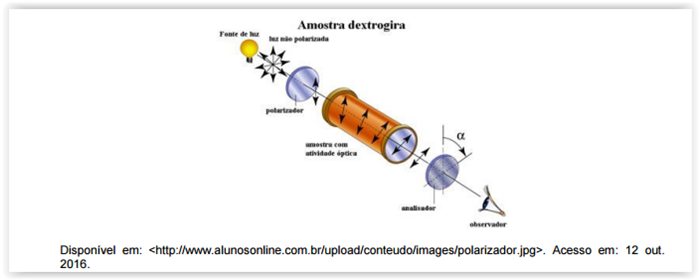
Considere a figura a seguir.
A figura apresenta a escala de pH de vários materiais conhecidos cotidianamente.
Essa grandeza
Um laboratorista propôs experimentos simples de diferenciação de compostos iônicos e covalentes. Para tanto, realizou testes de condutibilidade elétrica em água e determinação do ponto de fusão do açúcar comum (sacarose) e do sal de cozinha (cloreto de sódio). Esses dois testes possibilitaram ao laboratorista concluir que:
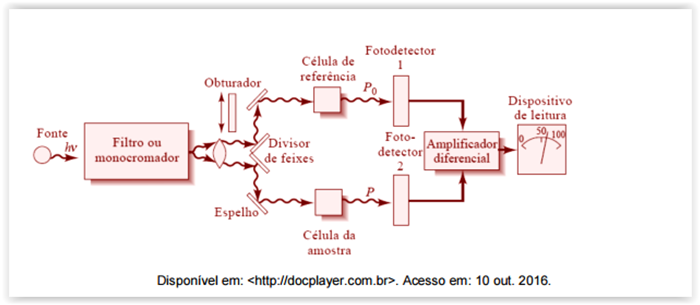
Considere a figura a seguir.
figura ilustra um espectrofotômetro, cujo princípio baseia-se na
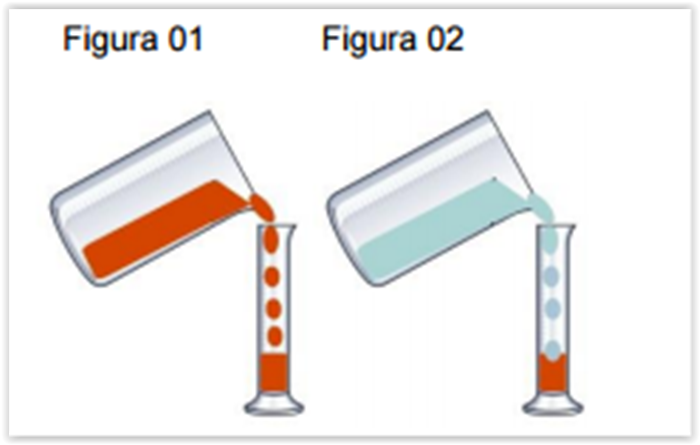
Considere as figuras a seguir
A Figura 01 representa a adição de 50 mL gasolina em uma proveta. Sabe-se que essa
gasolina, obtida em postos de combustíveis, possui álcool etílico na mistura. Na sequência,
Figura 02, foram adicionados, à mesma proveta, 50 mL de água. Após cuidadosa agitação, e
passado o tempo de repouso, observou-se
Considere a representação a seguir
A representação pode ser interpretada como:
As ligações químicas entre átomos ou íons de um composto químico refletem em suas propriedades. Dentre os substâncias abaixo, assinale a alternativa que NÃO relaciona corretamente a substância ao tipo de ligação que ocorre entre seus átomos.
Diversos produtos químicos podem ser utilizados no tratamento da água em ETA’s. As fórmulas químicas que correspondem ao sulfato de alumínio; hipoclorito de cálcio, aluminato de sódio e óxido de cálcio são, respectivamente:
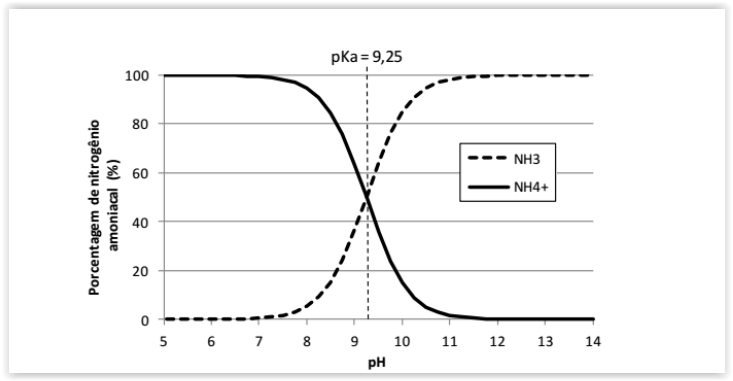
A amônia é um gás incolor à temperatura ambiente e possui um odor
extremamente forte. Seu caráter polar é a principal razão para a sua solubilidade em
água, sendo que em ambientes aquáticos, o nitrogênio amoniacal compreende as
formas do íon amônio (NH4+) e da amônia (NH3) dissolvidos, de maneira que a
proporção entre elas depende da temperatura, salinidade e, principalmente, do pH
do meio.
De acordo com o gráfico acima e os conhecimentos sobre equilíbrio químico.
Assinale a alternativa CORRETA:
As técnicas eletroanalíticas se baseiam em processos de ________onde as espécies eletroativas do meio oferecem resposta à aplicação de um _______para o monitoramento da corrente elétrica ou valor do potencial em comparação ao potencial de um eletrodo de referência. A ________e a _______são bastante utilizadas em análises de espécies eletroativas orgânicas e inorgânicas e na determinação seletiva de íons orgânicos e inorgânicos em solução, respectivamente. Assinale a alternativa que corresponde as palavras CORRETAS para cada respectivo espaço vazio.